
【题目】埋在地下的铸铁输油管道,在下列各种情况下,被腐蚀速率最慢的是
A. 在含铁元素较多的酸性土壤中 B. 在潮湿疏松的碱性土壤中
C. 在干燥致密不透气的土壤中 D. 在含碳粒较多,潮湿透气的中性土壤中
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】某有机物的分子式是C3H6O2。以下说法正确的是 ( )
A. 不能发生氧化反应 B. 至少有三种同分异构体可以水解得到甲酸或甲醇
C. 至少有三种同分异构体能与NaOH溶液反应 D. 分子中含有碳碳双键或碳氧双键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苹果汁饮料中含有Fe2+,鲜榨的苹果汁在空气中会由淡绿色变为棕黄色,榨汁时加入维生素C可有效防止这种现象发生,说明维生素C具有
A.氧化性B.还原性C.酸性D.碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列食品添加剂与类别对应正确的一组是
A.着色剂---苯甲酸钠B.营养强化剂---粮食制品中加赖氨酸
C.调味剂---亚硝酸钠D.防腐剂---柠檬黄
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应NO2(g)+ CO(g) ![]() CO2(g)+ NO(g) 反应过 程中的能量变化如图所示,下列说法正确的是
CO2(g)+ NO(g) 反应过 程中的能量变化如图所示,下列说法正确的是
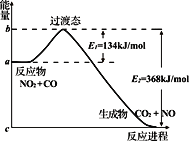
A. 1molNO2与1molCO混合经充分反应放热234 kJ
B. 若反应开始时加入催化剂, 则使E1 、E2 都变大
C. 正反应的活化能是134kJ/mol
D. 该反应的反应热⊿H = E2–E1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象如下表。
实验方案 | 实验现象 |
①用砂纸擦后的镁带与沸水反应,再向反应后溶液中滴加酚酞 | (A)浮于水面,熔成一个小球,在水面上无定向移动,随之消失,溶液变红色 |
②向新制的H2S饱和溶液中滴加新制的氯水 | (B)产生气体,可在空气中燃烧,溶液变成浅红色 |
③钠与滴有酚酞试液的冷水反应 | (C)反应不十分强烈,产生的气体可以在空气中燃烧 |
④镁带与2molL-1的盐酸反应 | (D)剧烈反应,产生可燃性气体 |
⑤铝条与2molL-1的盐酸反应 | (E)生成淡黄色沉淀 |
请你帮助该同学整理并完成实验报告:
(1)实验目的:探究同周期元素的金属性和非金属性的递变规律。
(2)实验用品:
仪器:①试管②酒精灯③胶头滴管④试管夹⑤镊子⑥小刀⑦玻璃片⑧砂纸⑨烧杯等。
药品:钠、镁带、铝条、2molL-1的盐酸、新制的氯水、饱和的H2S溶液等。
(3)实验内容:(填写与实验方案相对应的实验现象)
①②③④⑤(用A-E表示)_____________________
写出③的离子方程式_________________________。
(4)实验结论:_______________________________。
II.实验室利用如图装置进行中和热的测定,请回答下列问题:

(1)从实验装置上看,图中尚缺少一种玻璃仪器是______________________。
(2)做1次完整的中和热测定实验,温度计需使用次_____________________________。
(3)某同学为了省去清洗温度计的麻烦,建议实验时使用两支温度计分别测量酸和碱的温度,你是否同意该同学的观点,为什么?______________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、R为前四周期原子序数依次增大的元素。X原子有3个能级,且每个能级上的电子数相等;Z原子的不成对电子数在同周期中最多,且Z的气态氢化物在同主族元素的氢化物中沸点最低;X、Y、R三元素在周期表中同族。
(1)R元素在周期表中的位置是_______________________,其基态原子的价层电子排布图为__________________________。
(2)下图表示X、Y、Z的四级电离能变化趋势,其中表示Z的曲线是_________(填标号)。

(3)化合物(XH2=X=O)分子中X原子杂化轨道类型是___________,1mol (X2H5O)3Z=O分子中含有的σ键与π键的数目比为_______________。
(4)Z与氯气反应可生成一种各原子均满足8电子稳定结构的化合物,其分子的空间构型为______。
(5)某R的氧化物晶胞结构如下图所示,该物质的化学式为____________。已知该晶体密度为ρg/cm3,距离最近的两个原子的距离为d pm,则R的相对原子质量为___________________。 (阿伏加德罗常数为NA)

(6)X形成的一种常见单质,性质硬而脆,原因是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,既是吸热反应又是氧化还原反应的是
A.Ba(OH)2·8H2O与NH4ClB.Al与稀盐酸
C.灼热的炭与水蒸气生成一氧化碳和氢气D.铝热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的量的计算是中学化学的重要内容,完成以下填空:
(1)相同质量的SO2、SO3的物质的量之比为_______,氧原子的个数之比为________。
(2)0.3 mol NH3分子中所含原子数与________个H2O分子中所含原子数相等(NA表示阿佛加德罗常数)。
(3)标准状况下,2.4 g某气体的体积为672 mL,则此气体的相对分子质量为______。
(4)含0.4 mol Al3+的Al2(SO4)3中所含的硫酸根离子的物质的量是__________mol。
(5)100 mL 1.0 mol·L-l 稀硫酸与300 mL 1.0 mol·L-l BaCl2溶液混合,所得溶液中H+ 的物质的量浓度为____(忽略混合时溶液体积的变化).
(6)某氯化镁溶液的密度为d g/cm3,其中镁离子的质量分数为w,a mL该溶液中Cl— 的物质的量为____mol.
(7)已知4 mol·L-l 的硫酸溶液密度为ρ1,2 mol·L-l 的硫酸溶液密度为ρ2。100g浓度为4 mol·L-l 的硫酸溶液与____mL水混合,使硫酸的物质的量浓度减小到2 mol·L-l 。(用含ρ1、ρ2的式子表示).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com