
| A. | △H=244.1 kJ•mol-1 | B. | △H=-488.3 kJ•mol-1 | ||
| C. | △H=-996.6 kJ•mol-1 | D. | △H=996.6 kJ•mol-1 |
分析 依据热化学方程式和盖斯定律计算分析,反应的焓变与反应过程无关,只与起始状态和终了状态有关,
已知 ①C(s)+O2(g)═CO2(g)△H1=-393.5kJ/mol
②H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H2=-285.8kJ/mol
③CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H3=-870.3kJ/mol
依据盖斯定律(1)×2-(3)+(2)×2得到.
解答 解:已知 ①C(s)+O2(g)═CO2(g)△H1=-393.5kJ/mol
②H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H2=-285.8kJ/mol
③CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H3=-870.3kJ/mol
依据盖斯定律(1)×2-(3)+(2)×2得到
2C(s)+2H2(g)+O2(g)═CH3COOH(l)△H=(-393.5kJ/mol)×2-(-870.3kJ/mol)+(-285.8kJ/mol)×2=-488.3 kJ/mol
故选B.
点评 本题考查热化学方程式的书写和盖斯定律的计算应用,题目较简单,掌握基础是解题关键.


科目:高中化学 来源: 题型:解答题
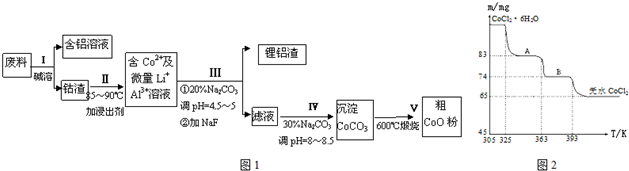
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放热反应在任何条件都能自发进行 | |
| B. | 化学反应的热效应数值与参加反应的物质多少有关 | |
| C. | 任何酸与碱发生中和反应生成1 mol H2O的过程中,能量变化均相同 | |
| D. | 焓变是指1 mol物质参加反应时的能量变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能使石蕊试液变红色的溶液中:Na+、CO32-、K+、ClO-、I- | |
| B. | 能与金属铝反应放出H2的溶液中:K+、NO3-、Cl-、NH4+ | |
| C. | 常温下水电离出的c(H+)•c(OH-)=10-20mol/L的溶液中:Na+、Cl-、S2-、SO32- | |
| D. | 中性溶液:K+、HCO3-、NO3-、SO42-、Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑤ | B. | ①④ | C. | ③⑥ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
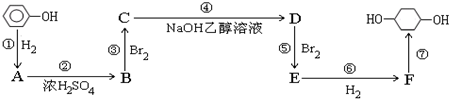
 ,F
,F ;A含有的官能团名称是羟基;
;A含有的官能团名称是羟基;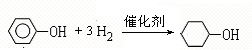 ;
; +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$ +2NaBr.
+2NaBr.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlCl3溶液和NaOH溶液 | B. | NaAlO2和HCl溶液 | ||
| C. | NaHCO3溶液和HCl溶液 | D. | AgNO3溶液和氨水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 序号 | 反应温度/℃ | Na2S2O3溶液 | 稀H2SO4 | H2O | ||
| V/mL | c/mol•L-1 | V/mL | c/mol•L-1 | V/mL | ||
| 1 | 25 | 5 | 0.1 | 10 | 0.1 | 5 |
| 2 | 25 | 5 | 0.2 | 5 | 0.2 | 10 |
| 3 | 35 | 5 | 0.1 | 10 | 0.1 | 5 |
| A. | 实验1和实验2可以探究Na2S2O3浓度对反应速率的影响 | |
| B. | 实验1和实验3可以探究温度对反应速率的影响 | |
| C. | 通过测定单位时间内收集到气体的体积判断化学反应速率快慢 | |
| D. | 实验3时,应先分别将Na2S2O3溶液、H2SO4溶液和水置于热水浴中加热到所需温度再混合发生反应,记录反应所需时间 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
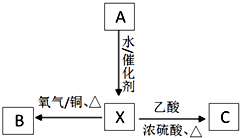 A为标准状况下密度为1.25g•L-1的常见气态烃.有关物质的转化关系如图:请回答:
A为标准状况下密度为1.25g•L-1的常见气态烃.有关物质的转化关系如图:请回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com