
| 选项 | 实验目的 | 操作 | 现象 |
| A | 比较酸性:HF>H2CO3 | 向盛有少量NaHCO3溶液的试管中滴加足量HF溶液 | 有无色气体产生 |
| B | 验证SO2的漂白性 | 将SO2通入石蕊溶液中 | 石蕊溶液褪色 |
| C | 比较非金属性:Br>I | 将溴水滴加到KI-淀粉溶液中 | 溶液变蓝 |
| D | 检验某溶液中是否含有SO42- | 向盛有少量待测液的试管中先滴加Ba(NO3)2溶液,再滴加稀盐酸 | 有白色沉淀生成 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.氢氟酸酸性大于碳酸;
B.二氧化硫与水反应生成亚硫酸,具有酸性,能够使石蕊溶液变红色,二氧化硫不能漂白指示剂;
C.溴单质与碘化钾反应生成碘单质;
D.根据加入硝酸钡,溶液中存在了硝酸根离子,再加入盐酸时引入氢离子,就相当于存在了硝酸,将亚硫酸根离子氧化为硫酸根离子,与钡离子形成不可溶的硫酸钡沉淀,也可能含有亚硫酸根离子.
解答 解:A.氢氟酸酸性大于碳酸,可生成二氧化碳,故A正确;
B.二氧化硫与水反应生成亚硫酸,具有酸性,能够使石蕊溶液变红色,二氧化硫不能漂白指示剂,所以看到的现象是只变红色不褪色,故B错误;
C.溴单质与碘化钾反应生成碘单质,氧化剂氧化性大于氧化产物,故C正确;
D.因为加入的是硝酸钡,溶液中存在了硝酸根离子,再加入盐酸时引入氢离子,就相当于存在了硝酸,将亚硫酸根离子氧化为硫酸根离子,与钡离子形成不可溶的硫酸钡沉淀,也可能含有亚硫酸离子,故D错误.
故选AC.
点评 本题考查化学实验方案的评价,为高频考点,把握强酸制弱酸规律、非金属性比较、离子检验等为解答的关键,注意性质及反应现象的综合分析,侧重实验评价性的考查,题目难度不大.


 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
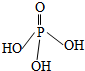 三聚磷酸可视为三个磷酸分子(磷酸结构式如图)之间脱去两个水分子的产物,三聚磷酸钠(俗称“五钠”)是常用的水处理剂.下列说法错误的是( )
三聚磷酸可视为三个磷酸分子(磷酸结构式如图)之间脱去两个水分子的产物,三聚磷酸钠(俗称“五钠”)是常用的水处理剂.下列说法错误的是( )| A. | 三聚磷酸中P的化合价为+5 | |
| B. | 三聚磷酸钠的化学式为Na3P3O10 | |
| C. | 按上述原理,四聚磷酸的化学式为H6P4O13 | |
| D. | 多聚磷酸的结构可表示为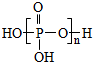 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1molNaOD溶于重水制成1L溶液,pD=13 | |
| B. | 将pD=4的DCl的重水溶液稀释100倍,所得溶液pD不等于6 | |
| C. | 向30mL0.5mol•L-1NaOD的重水溶液中加入20mL0.5mol•L-1DCl的重水溶液,所得溶液pD=11 | |
| D. | pD=10的NaOD的重水溶液中,由重水电离出的c(OD-)为1×10-10mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com