
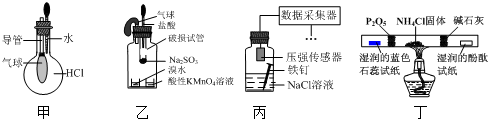
| A. | 用装置甲验证HCl气体易溶于水 | |
| B. | 用装置乙验证SO2具有漂白性 | |
| C. | 用装置丙采集到的压强数据判断铁钉发生析氢腐蚀还是吸氧腐蚀 | |
| D. | 用装置丁检验NH4Cl分解产生的气体 |
分析 A.HCl极易溶于水,挤压胶头滴管,气球变大;
B.生成的二氧化硫与溴水或高锰酸钾均发生氧化还原反应;
C.NaCl溶液为中性,发生吸氧腐蚀,瓶内压强减小;
D.NH4Cl分解生成氨气、HCl,氨气可使酚酞试纸变蓝,HCl可使湿润的蓝色石蕊试纸变红,五氧化二磷、碱石灰均可除杂.
解答 解:A.HCl极易溶于水,挤压胶头滴管,气球变大,则装置甲可验证HCl气体易溶于水,故A正确;
B.生成的二氧化硫与溴水或高锰酸钾均发生氧化还原反应,可验证其还原性,与漂白无关,故B错误;
C.NaCl溶液为中性,发生吸氧腐蚀,瓶内压强减小,则装置丙采集到的压强数据判断铁钉发生析氢腐蚀还是吸氧腐蚀,故C正确;
D.NH4Cl分解生成氨气、HCl,氨气可使酚酞试纸变蓝,HCl可使湿润的蓝色石蕊试纸变红,五氧化二磷、碱石灰均可除杂,则装置丁可检验NH4Cl分解产生的气体,故D正确;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、发生的反应、实验装置的作用等为解答的关键,侧重分析与实验能力的考查,注意实验评价性分析,题目难度不大.


科目:高中化学 来源: 题型:选择题
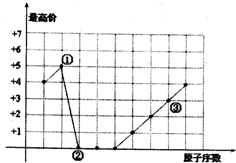
| A. | ①、②形成的化合物的摩尔质量可能是44g/mol | |
| B. | ①、③可以按原子个数比1:l形成化合物 | |
| C. | ②、③形成的化合物是两性物质 | |
| D. | 单核简单离子半径大小为:②<③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:X<Y<Z<W | |
| B. | 气态氢化物的稳定性:Y>Z>W | |
| C. | Y、Z、W均可与Mg形成离子化合物 | |
| D. | 最高价氧化物对应水化物的酸性:Y>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
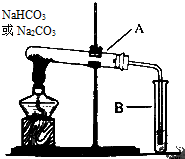 某校化学兴趣小组,通过如图装置探究Na2CO3和NaHCO3的热稳定性,探究方案设计如下,请你参与并完成该探究方案.
某校化学兴趣小组,通过如图装置探究Na2CO3和NaHCO3的热稳定性,探究方案设计如下,请你参与并完成该探究方案.查看答案和解析>>
科目:高中化学 来源: 题型:解答题


| 实验装置 | 实验药品 | 制备原理 | |
| 甲小组 | A | 氢氧化钙、硫酸铵 | 反应的化学方程式为①(NH4)2SO4+Ca(OH)2═2NH3↑+2H2O+CaSO4 |
| 乙小组 | ②B | 浓氨水、氢氧化钠 | 用化学平衡原理分析氢氧化钠的作用______ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室中利用含银废料(主要含有AgNO3和AgCl)制取硝酸银的实验步骤如下:
实验室中利用含银废料(主要含有AgNO3和AgCl)制取硝酸银的实验步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大压强,则反应的②K不变,反应①和③的K减小 | |
| B. | 500℃时,2NH3 (g)+2O2 (g)?N2O (g)+3H2O (g) K=2.2×1028 | |
| C. | 500℃时,N2 (g)+O2 (g)=2NO (g)△H=+181 kJ•mol-1 | |
| D. | 500℃时,2 mol NH3与2.5 mol O2混合发生反应①,可放出热量453.6 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
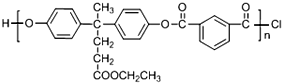
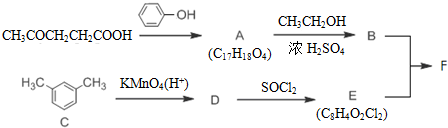
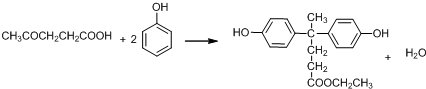
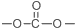
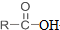 +SOCl2→
+SOCl2→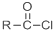 +SO2+HCl
+SO2+HCl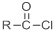 +R′OH→
+R′OH→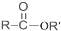 +HCl(R、R′表示烃基)
+HCl(R、R′表示烃基)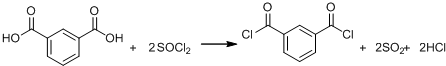 .
. .
. 结构.
结构.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
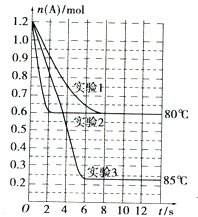 将1.2mol的A气体充入2L恒容密闭容器中发生反应:A(g)?2B(g).在三种不同条件下进行实验,A的物质的量随时间的变化如图所示.试回答下列问题:
将1.2mol的A气体充入2L恒容密闭容器中发生反应:A(g)?2B(g).在三种不同条件下进行实验,A的物质的量随时间的变化如图所示.试回答下列问题:| 实验编号 及其目的 | V(容积)/L | t/℃ | n(A起始)/mol | n(B起始)/mol | 催化剂的质量/g | 催化剂的表面积/m2•g-1[来源:Z.xx.k.Com] |
| 实验1 参照对比实验 | 2 | 80 | 1.2 | 0 | a | b |
| 实验4:催化剂的表面积对反应速率的影响 | | | | | | |
| 实验5目的: | 1 | | | | | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com