
【题目】Ⅰ实验室里需要纯净的氯化钠溶液,但实验室只有混有硫酸钠、碳酸氢铵的氯化钠.某学生设计了如下方案进行提纯:
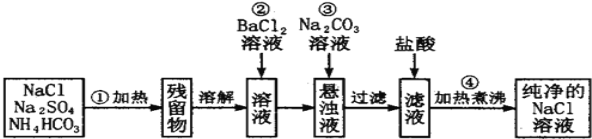
(1)操作②能否改为加硝酸钡溶液,______(填“能”或“否”) ,理由_____________________________。
(2)进行操作②后,如何判断SO42- 已除尽,方法是___________________。
(3)操作④的目的是_______________________________。
Ⅱ硫酸亚铁铵(NH4)2SO4·FeSO4·6H2O为浅绿色晶体,实验室中常以废铁屑为原料来制备,其步骤如下:
步骤1 将废铁屑放入碳酸钠溶液中煮沸除油污,分离出液体,用水洗净铁屑。
步骤2 向处理过的铁屑中加入过量的3mol/L H2SO4溶液,在60℃左右使其反应到不再产生气体,趁热过滤,得FeSO4溶液。
步骤3 向所得FeSO4溶液中加入饱和(NH4)2SO4溶液,经过“一系列操作”后得到硫酸亚铁铵晶体。
请回答下列问题:
(1)在步骤1中,分离操作,所用到的玻璃仪器有___________________________。(填仪器编号)
①漏斗 ②分液漏斗 ③烧杯 ④广口瓶 ⑤铁架台 ⑥玻璃棒 ⑦酒精灯
(2)在步骤3中,“一系列操作”依次为_____________________、_______________________和过滤。
(3)实验室欲用18mol/L H2SO4来配制240mL 3mol/L H2SO4溶液,需要量取________mL浓硫酸,实验时,下列操作会造成所配溶液浓度偏低的是__________________。(填字母)
a.容量瓶内壁附有水珠而未干燥处理 b.未冷却至室温直接转移至容量瓶中
c.加水时超过刻度线后又倒出 d.定容时仰视刻度线
【答案】否 改用Ba(NO3)2会使溶液中引入新的杂质离子NO3- 静置,向上层清液中继续滴加BaCl2溶液,溶液不变浑浊,则已除尽 除去滤液中溶解的CO2和多余的盐酸 ①③⑥ 蒸发浓缩 降温结晶 41.7 c d
【解析】
Ⅰ(1) 操作②改为加硝酸钡溶液,会引入新的杂质离子NO3-,得不到纯的氯化钠;
(2) 用氯化钡溶液来判断SO42- 是否已除尽;
(3)操作④进行加热煮沸,可以除去滤液中溶解的CO2和多余的盐酸;
Ⅱ(1)根据过滤操作中所用到的玻璃仪器选用所需的仪器;
(2)由溶液制晶体时,要经过加热浓缩、冷却结晶、过滤、洗涤等步骤;
(3)根据溶液稀释前后溶质的量不变,计算出所需浓硫酸的体积;根据c=n/V进行分析,凡是引起n偏小或V偏大,所测定的结果都会使所配溶液浓度偏低。
Ⅰ(1)本实验的目的最终得到纯净的氯化钠溶液,因此操作②中改为加硝酸钡溶液,会引入新的杂质离子NO3-,得不到纯的氯化钠,因此不能用Ba(NO3)2溶液代替BaCl2溶液;综上所述,本题答案是:否,改用Ba(NO3)2会使溶液中引入新的杂质离子NO3-。
(2) 操作②,加入氯化钡溶液,目的是除去硫酸根离子,因此判断SO42- 已除尽方法是:静置,向上层清液中继续滴加BaCl2溶液,溶液不变浑浊,则已除尽;综上所述,本题答案是:静置,向上层清液中继续滴加BaCl2溶液,溶液不变浑浊,则已除尽。
(3)滤液中剩余的碳酸钠与过量的盐酸反应生成二氧化碳、氯化钠,因此操作④进行的加热煮沸,其目的是除去滤液中溶解的CO2和多余的盐酸;综上所述,本题答案是:除去滤液中溶解的CO2和多余的盐酸。
Ⅱ(1)进行过滤操作,所用到的玻璃仪器有①漏斗,③烧杯,⑥玻璃棒;综上所述,本题答案是:①③⑥。
(2)由溶液制晶体时,要经过加热浓缩、冷却结晶、过滤、洗涤等步骤;本题中一系列操作”依次为加热浓缩、降温结晶和过滤;综上所述,本题答案是:蒸发浓缩 ;降温结晶。
(3)根据溶液稀释前后溶质的量不变规律,实验室没有240mL容量瓶,只能选用250mL容量瓶,因此18×V(浓H2SO4)=250×3, V(H2SO4)=41.7mL;实验时,下列操作会造成偏低的是:
a.容量瓶内壁附有水珠而未干燥处理,不影响溶质的量和溶液的体积,对无影响,不选;
b.未冷却至室温直接转移至容量瓶中,等溶液冷却到室温后,溶液的体积会偏小,所配溶液浓度偏大,不选;
c.加水时超过刻度线后又倒出,造成溶质的量减少,所配溶液浓度偏低,可选;
d.定容时仰视刻度线,造成溶液的体积偏高,所配溶液浓度偏低,可选;
综上所述,本题正确答案是:41.7 ,cd。


科目:高中化学 来源: 题型:
【题目】阿魏酸是用于治疗心脑血管疾病及白细胞减少等症药品的基本原料。下面是以石炭酸为原料制备阿魏酸的一种合成路线:
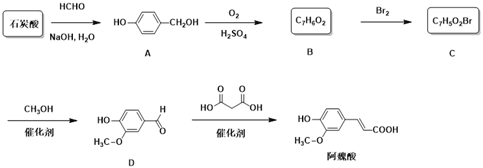
(1)由石炭酸生成A和A生成B的反应类型分别为____、______。
(2)阿魏酸有顺式和反式两种结构,其顺式结构的结构简式为________。
(3)C中官能团名称为__________。
(4)由B生成C的化学反应方程式为___________________。
(5)芳香化合物E是D的同分异构体,0.1 mol E能与饱和碳酸氢钠溶液反应放出4.4g CO2,其核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为2∶2∶1∶3,写出符合要求的E的结构简式____________。
(6)由谷维素(![]() )也可制备阿魏酸,请设计简单的合成路线并写出相应的化学反应方程式_________。
)也可制备阿魏酸,请设计简单的合成路线并写出相应的化学反应方程式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】8NH3+3Cl2 ===6NH4Cl+N2,反应中氧化剂和还原剂的质量比是( )
A. 8:3 B. 213:136 C. 34:213 D. 213:34
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“飘尘”是物质燃烧时产生的粒子漂浮物,颗粒很小(直径小于10-7m),不易沉降(可漂浮数小时或数年),它与空气中SO2、O2接触时,SO2部分转化为SO3,使空气酸度增加,形成酸雨。
(1)飘尘所起的主要作用是____。
A.氧化剂 B.催化剂 C.吸附剂 D.还原剂
(2)与雨水形成酸雨,试写出这两个化学反应式:_____________。
(3)汽车排放的尾气、硝酸厂和化肥厂的废气含有氮氧化物,全世界每年排放量约5×107kgNO2溶于水生成___________酸。
(4)酸雨可导致下列哪种危害____。
A.腐蚀建筑物 B.导致树木枯萎
C.造成洪涝灾害 D.恶化人类环境
(5)人体中纯净的胃液是一种强酸性液体,pH在0.9---1.5之间。氢氧化铝是一种治疗胃酸过多的胃药主要成分,目前这种胃药已不常用,主要原因是____。
A.它不能中和胃酸 B.它的疗效太差
C.长期摄入铝元素不利于身体健康 D.它不易溶于胃酸
(6)制造焊锡时,把铅加入锡的主要原因是____。
A.增加抗腐蚀能力 B.降低熔点
C.增加延展性 D.增加硬度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下将35mL气态烷烃完全燃烧,恢复到原来状况下,得到二氧化碳气体140mL,则该烃的分子式为( )
A.C5H12B.C4H10C.C3H6D.C4H8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一合金由X、Y、Z、W四种金属组成,若将合金放入盐酸中只有Z、Y能溶解;若将合金置于潮湿空气中,表面只出现Z的化合物;若将该合金做阳极,用X盐溶液作电解液,通电时四种金属都以离子形式进入溶液中,但在阴极上只析出X。这四种金属的活动性顺序是
A. Y>Z>W>X B. Z>Y>W>X
C. W>Z>Y>X D. X>Y>Z>W
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有两种金属混合物3.4g,与足量的盐酸反应放出H22.24L(标况下),这两种金属可能是
A. 铜和铁 B. 镁和铝 C. 锌和铝 D. 锌和铁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1mol/L的盐酸滴定0.1mol/L的Na2CO3溶液25mL。测得溶液pH变化曲线如图,下列说法正确的是( )
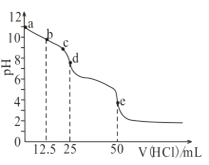
A. b点时,c(CO32-)>c(HCO3-)>c(OH-)
B. d点时,c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
C. e点时,c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)
D. c→d发生的主要离子反应:H++HCO3-=CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】古诗是古人为我们留下的宝贵精神财富。下列诗句中不涉及氧化还原反应的是
A.野火烧不尽,春风吹又生B.粉身碎骨浑不怕,要留清白在人间
C.春蚕到死丝方尽,蜡炬成灰泪始干D.爆竹声中一岁除,春风送暖入屠苏
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com