

分析 酸性甲烷燃料电池中通入甲烷的一极为原电池的负极,通入氧气的一极为原电池的正极,乙池为电解池,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,N连接原电池的正极,应为电解池的阳极,则应为石墨材料,M为电解池的阴极,为铁电极,电解硝酸银溶液时,阴极反应式为Ag++e-=Ag,阳极反应式为4OH--4e-=O2↑+2H2O,结合电子的转移的物质的量进行计算.
解答 解:(1)酸性甲烷燃料电池中通入甲烷的一极为原电池的负极,通入氧气的一极为原电池的正极,乙池为电解池,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,N连接原电池的正极,应为电解池的阳极,则应为石墨材料,N为阳极,电极反应式是4OH--4e-=O2↑+2H2O,M为阴极,电极材料为Fe,电极反应式为Ag++e-=Ag,发生的电解总化学反应方程式为 4AgNO3+2H2O$\frac{\underline{\;通电\;}}{\;}$4Ag+O2↑+4HNO3,
故答案为:Fe;4OH--4e-=O2↑+2H2O; 4AgNO3+2H2O $\frac{\underline{\;通电\;}}{\;}$4Ag+O2↑+4HNO3;
(2)甲池中通入甲烷的一极为负极,发生失电子的氧化反应,碱性环境下,电极反应式为CH4-8e-+10OH-=CO32-+7H2O,故答案为:CH4-8e-+10OH-=CO32-+7H2O;
(3)n(Ag)=$\frac{4.32g}{108g/mol}$=0.04mol,根据Ag++e-=Ag可知转移电子为0.04mol,
甲池中通入氧气的一极为正极,反应式为2O2+8H++8e-=4H2O,则消耗n(O2)=$\frac{1}{4}$×0.04mol=0.01mol,
V(O2)=0.01mol×22.4L/mol=0.224L,此时乙池发生的电解总化学反应方程式为 4AgNO3+2H2O$\frac{\underline{\;通电\;}}{\;}$4Ag+O2↑+4HNO3,转移电子为0.04mol,生成硝酸是0.04mol,溶液的体积为400mL,则乙池中溶液的H+的浓度为$\frac{0.04mol}{0.4L}$=0.1mol/L,
故答案为:0.224;0.1mol/L.
点评 本题考查了原电池原理和电解池原理,明确原电池和电解池电极上发生反应的类型即可分析解答本题,难度不大,注意电极反应式的书写与电解质溶液的酸碱性有关.


 作业辅导系列答案
作业辅导系列答案科目:高中化学 来源: 题型:解答题
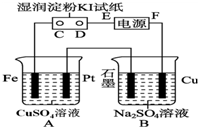 用如图所示的装置进行电解.通电一会儿,发现用NaCl溶液湿润的淀粉KI试纸的C端变为蓝色.
用如图所示的装置进行电解.通电一会儿,发现用NaCl溶液湿润的淀粉KI试纸的C端变为蓝色.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 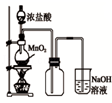 如图中:MnO2过量,盐酸能全部消耗 | B. | 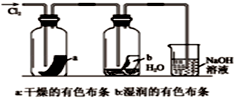 如图中:湿润的有色布条能褪色 | ||
| C. | 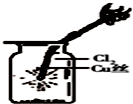 如图中:生成棕色的烟 | D. | 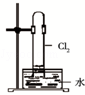 如图中:水可以充满试管 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S2- | B. | S4O62- | C. | S2O42- | D. | SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨溶于的喷泉实验,说明氨气极易溶于水 | |
| B. | 常温下,浓硝酸可用铝罐来贮存,说明浓硝酸具有强氧化性 | |
| C. | 氯气可使湿润的红色布条褪色,说明次氯酸具有漂白性 | |
| D. | 向蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸有吸水性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com