
【题目】[Cu(NH3)4]SO4·H2O是一种重要的染料及合成农药中间体,受热可分解。某化学课外小组设计了如下实验(部分夹持装置略)验证它的部分分解产物,请回答问题:
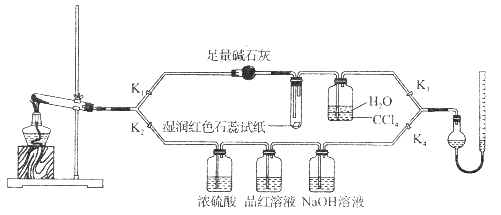
(1)连接装置,_________________________,在各装置中加入相应的药品和试剂。
(2)打开K2、K4,闭合K1、K3,加热一段时间后观察到品红溶液褪色,写出NaOH溶液中发生反应的离子方程式_____________________。
(3)打开K1、K3,闭合K2、K4,继续加热一段时间后观察到湿润红色石蕊试纸变蓝,证明分解产物中含有________________(填化学式)。
(4)CCl4的作用是__________________。
(5)加热过程中,还生成Cu、N2和H2O。写出[Cu(NH3)4]SO4·H2O分解的化学方程式________________。
(6)若实验中称取a g [Cu(NH3)4]SO4 · H2O,收集到b mL N2(已换算成标准状况),[Cu(NH3)4]SO4·H2O的分解率表达式为_______________。
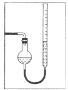
(7)量气管读数时需注意的事项有:①气体冷却到室温;②量气装置两侧液面相平;③______________。若某同学按右图所示读数,则计算出的分解率_______________(填“偏高”“偏低”或“无影响”)。
【答案】
(1)检查装置气密性;
(2)SO2 + 2OH– = SO32– +H2O;
(3)NH3;(4)防止倒吸
(5)3[Cu(NH3)4]SO4·H2O![]() 3Cu + 8NH3↑ + 2N2↑ + 3SO2↑ + 9H2O
3Cu + 8NH3↑ + 2N2↑ + 3SO2↑ + 9H2O
(6)![]() ;
;
(7)视线与凹液面最低处相平;偏低
【解析】
试题分析:(1)加热中有气体生成,由装置图可知,还进行气体体积的测定,加入药品前需要检验装置气密性,故答案为:检查装置气密性;
(2)观察到品红溶液褪色,说明分解生成二氧化硫,氢氧化钠溶液吸收二氧化硫生成亚硫酸钠,便于后续气体体积测定,反应离子方程式为:SO2+2OH-=SO32-+H2O,故答案为:SO2+2OH-=SO32-+H2O;
(3)观察到湿润红色石蕊试纸变蓝,说明分解生成氨气,故答案为:NH3;
(4)用水吸收生成氨气,以便于后续气体体积的测定,而氨气极易溶于水,直接用水吸收会发生倒吸,导管伸入四氯化碳中,氨气不被四氯化碳吸收,可以防止倒吸,故答案为:防止倒吸;
(5)加热过程中,还生成Cu、N2和H2O,由上述分析可知有氨气、二氧化硫生成,[Cu(NH3)4]SO4H2分解的化学方程式为:3[Cu(NH3)4]SO4H2O![]() 3Cu+8NH3↑+2N2↑+3SO2↑+9H2O,故答案为:3[Cu(NH3)4]SO4H2O
3Cu+8NH3↑+2N2↑+3SO2↑+9H2O,故答案为:3[Cu(NH3)4]SO4H2O![]() 3Cu+8NH3↑+2N2↑+3SO2↑+9H2O;
3Cu+8NH3↑+2N2↑+3SO2↑+9H2O;
(6)设分解的[Cu(NH3)4]SO4H2O的质量为m,则:
3[Cu(NH3)4]SO4H2O![]() 3Cu+8NH3↑+2N2↑+3SO2↑+9H2O
3Cu+8NH3↑+2N2↑+3SO2↑+9H2O
3×246g 2×22.4L
m b×10-3L
所以m=![]() =
=![]() g,
g,
[Cu(NH3)4]SO4H2O的分解率表达式为(![]() g÷ag)×100%=
g÷ag)×100%=![]() ×100%,
×100%,
故答案为:![]() ×100%;
×100%;
(7)读数还需要视线与凹液面最低处相平;若某同学按图2所示读数,气体的压强大于大气压,气体被压缩,测定气体的体积偏小,计算分解的[Cu(NH3)4]SO4H2O的质量偏小,故[Cu(NH3)4]SO4H2O的分解率偏低,故答案为:视线与凹液面最低处相平;偏低。


 百年学典课时学练测系列答案
百年学典课时学练测系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.伴有能量变化的物质变化,都是化学变化
B.干冰升华时,二氧化碳分子中的共价键不发生断裂
C.凡经加热而发生的化学反应都是吸热反应
D.C(石墨,s)===C(金刚石,s),反应中既没有电子得失也没有能量变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下呈液态的高级脂肪酸的甘油酯称为_______,呈固态的称为_______,它们统称为油脂。油脂分子烃基里所含的不饱和键越多,熔点越__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】部分氧化的Fe-Cu合金样品(氧化产物为Fe2O3、CuO)共5.76g,经如下处理:

下列说法正确的是( )
A.V=44.8
B.原样品中Fe元素的质量分数为38.89%
C.滤液A中的阳离子为Fe2+、Fe3+、H+
D.样品中CuO的质量为4.0 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 做衣服的棉和麻均与淀粉互为同分异构体
B. 制饭盒、高压锅等的不锈钢是合金
C. 煎炸食物的花生油和牛油都是可皂化的饱和酯类
D. 磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)欲验证某溶液中含有较大量的Cl-、CO![]() 、SO
、SO![]() 三种离子,如果只取一次该溶液,分别用三种试剂将三种离子检验出来(要求每一种试剂能检验出一种离子)。假设所加试剂均为足量,则加入试剂的先后顺序为(写化学式)____________、______________、____________。
三种离子,如果只取一次该溶液,分别用三种试剂将三种离子检验出来(要求每一种试剂能检验出一种离子)。假设所加试剂均为足量,则加入试剂的先后顺序为(写化学式)____________、______________、____________。
(2)溶液中存在Mg2+、Ag+、Ba2+三种金属离子,现用NaOH、Na2CO3、NaCl三种溶液使它们分别沉淀并分离出来,要求每次只加一种溶液,滤出一种沉淀,所加溶液顺序写出对应的离子方程式_______________、_______________、________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,下列叙述中正确的是( )
A.标准状况下,11.2L苯中含有C﹣H键的数目为3NA
B.常温下,1.0LpH=13的Ba(OH)2溶液中含有的OH﹣数目为0.1NA
C.常温下,56g铁片投入足量浓H2SO4中生成NA个SO2分子
D.电解饱和食盐水,阳极产生22.4L气体时,电路中通过的电子数目为2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com