
(14分)甲学生对Cl2与FeCl2和KSCN混合溶液的反应进行实验探究。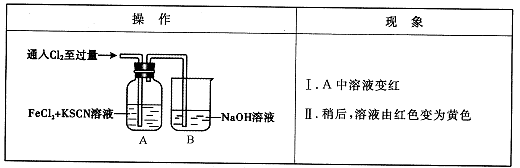
(1)B中反应的离子方程式是____。
(2)A中溶液变红的原因是____。
(3)为了探究现象II的原因,甲同学进行如下实验。
①取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在 。
②取A中黄色溶液于试管中,加入过量的KSCN溶液,最终得到红色溶液。
甲同学的实验证明产生现象Ⅱ的原因是SCN—与Cl2发生了反应。
(4)甲同学猜想SCN—可能被Cl2氧化了,他又进行了如下研究。
资料显示:SCN—的电子式为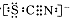
①甲同学认为SCN—中碳元素没有被氧化,理由是 。
②取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液,产生白色沉淀,由此证明SCN—中被氧化的元素是 。
③通过实验证明了SCN—中氮元素转化为NO3-,他的实验方案是____。
④若SCN—与Cl2反应生成1 mol CO2,则转移电子的物质的量是 mol。
(14分)
(1)Cl2+2 OH-= Cl-+ ClO-+ H2O;
(2)Fe2+被Cl2氧化生成Fe3+,Fe3+与SCN-反应生成红色Fe(SCN)3,所以溶液变红
(3)①Fe3+
(4)①SCN-中的碳元素是最高价态+4价
②硫元素
③取足量铜粉于试管中,加入A中黄色溶液和一定量的盐酸,加热,观察到试管上方有红棕色气体生成,证明A中存在NO3-,SCN-中氮元素被氧化成NO3-;
④16
解析试题分析:(1)B中是氯气与氢氧化钠的反应,离子方程式为Cl2+2 OH-= Cl-+ ClO-+ H2O;
(2)A中的Fe2+被Cl2氧化生成Fe3+,Fe3+与SCN-反应生成红色Fe(SCN)3,所以溶液变红
(3)①加入NaOH溶液,有红褐色沉淀生成,此红褐色沉淀为氢氧化铁沉淀,则溶液中一定存在Fe3+
(4)①因为SCN—中碳元素已经是最高价态+4价;
②与盐酸酸化的BaCl2溶液,产生白色沉淀,此白色沉淀为硫酸钡沉淀,所以被氧化的元素是硫元素;
③证明SCN—中氮元素转化为NO3-,利用硝酸的强氧化性,被还原的产物是红棕色气体,可证明SCN—中氮元素转化为NO3-,
④SCN—与Cl2反应生成1 mol CO2,说明有1mol的SCN—与Cl2反应,SCN—中的-2价S、-3价N化合价升高到+6价、+5价,失电子总数为8+8=16mol,所以转移电子的物质的量为16mol。
考点:考查Cl2与FeCl2和KSCN混合溶液的反应实验,离子检验,根据元素价态判断发生的反应,电子转移数目的确定


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:填空题
(一).对金属制品进行抗腐蚀处理,可延长其使用寿命。
以下为铝材表面处理的一种方法: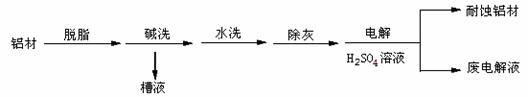
(1)碱洗的目的是除去铝材表面的自然氧化膜,碱洗时常有气泡冒出, 为将槽液中的铝以沉淀形式回收,最好向槽液中加入下列试剂中的 。 (填编号)
a.NH3 b.CO2 c.NaOH d.HNO3
(2)以铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,
阳极电极反应式为 。取少量废电解液,加入NaHCO3溶液,写出发生反应的离子方程式
(二).A—E五种元素中,除A、B外其他均为短周期元素它们的性质或原子结构如下表:
| 元素 | 元素性质或原子结构 |
| A | 单质为生活中常见的金属,该金属的两种黑色氧化物(其中一种有磁性)的相对分子质量相差160 |
| B | 单质为生活中常见的金属,其相对原子质量比A大8 |
| C | 地壳中含量最多的金属元素 |
| D | 元素的主族序数是其所在周期序数的3倍 |
| E | E的某种原子的原子核内没有中子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
铝及其化合物在生产生活中具有重要的作用。
(1)铝在元素周期表中的位置是 。
(2)已知电负性的数值表示原子对电子吸引能力的相对大小。以下是几种原子的电负性数值:
| 元素 | 钠 | 镁 | 铝 | 硅 |
| 电负性 | 0.9 | 1.2 | χ | 1.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知某物质A有如下转化关系: 
根据上图关系及实验现象,回答下列问题:
(1)A是 ,B是 ,G是 ,X是 (均填化学式)。
(2)写出反应Ⅱ的化学方程式 。
(3)写出反应Ⅲ的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
A、B、C、D均为中学化学中常见的单质或化合物,它们之间的关系如图所示(部分产物已略去)。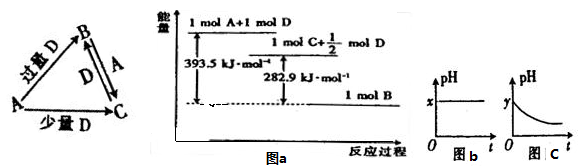
(1)若A为金属单质,D是某强酸的稀溶液,则反应C+D→B的离子方程式为 ;
(2)若A、B为盐,D为强碱,A的水溶液显酸性,则
①C的化学式为 ;
②反应B+A→C的离子方程式为 ;
(3)若A为强碱,D为气态氧化物。常温时,将B的水溶液露置于空气中,其pH随时间t变化可能如上图的图b或图c所示(不考虑D的溶解和水的挥发)。
①若图b符合事实,则D的化学式为 ;
②若图c符合事实,则其pH变化的原因是 (用离子方程式表示);
(4)若A为非金属单质,D是空气的主要成分之一。它们之间转化时能量变化如上图a,请写出A+D→C的热化学方程式 ;
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
已知A~G有如图所示的转化关系(部分生成物已略去),其中A、G为单质,D是能使湿润的红色石蕊试纸变蓝色的气体,E、F均能与NaOH溶液反应。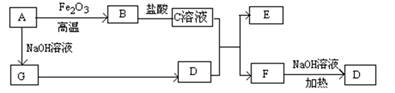
请回答下列问题:
(1)写出F的电子式 ;
(2)①C溶液与D反应的离子方程式为 ;
②F溶液与NaOH溶???共热反应的化学方程式为 ;
(3)①请用离子方程式解释C溶液为何显酸性 ;
②F溶液中离子浓度由大到小的顺序为 ;
(4)将5.4gA投入200mL 2.0mol/L某溶液中有G单质产生,且充分反应后有金属剩余,则该溶液可能是 (填代号)
A.HNO3溶液 B.H2SO4溶液 C.NaOH溶液 D.HCl溶液
(5)将1molN2和3molG及催化剂充入容积为2L的某密闭容器中进行反应,已知该反应为放热反应。平衡时,测得D的物质的量浓度为a mol/L。
①如果反应速率v(G)=1.2mol/(L·min),则v(D)= mol/(L·min)
②在其他条件不变的情况下,若起始时充入0.5molN2和1.5molG达到平衡后,D的物质的量浓度 (填“大于”、“小于”或“等于”)a/2 mol/L。
③该条件下的平衡常数为 (用含a的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
某已知A、B均是由两种短周期元素组成的化合物,A中某元素的质量分数为25%,B的焰色反应呈黄色,C、J、X是同周期的元素的简单氢化物,X为无色液体,C、J为气体,D是一种不溶于水的白色固体。反应生成的水均已略去。它们有如下图所示的关系。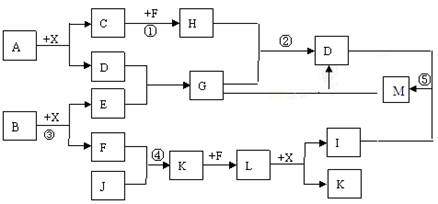
(1)写出化学式:A_________ E___________ L___________;
(2)在反应①②③④⑤中属于氧化还原反应的是_____________;
(3)反应③化学方程式为:______________________________;
(4)写出下列离子方程式:反应② ;G溶液与M溶液的反应___________。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
将70 g过氧化钠和氧化钠的混合物跟98 g水充分反应后,所得氢氧化钠溶液的质量分数为50%。
(1)求原混合物中过氧化钠和氧化钠的质量;(2)产生的气体标况下体积。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组的同学欲测定该补血剂中
铁元素的含量。实验步骤如下:
请回答下列问题:
(1)证明步骤①滤液中含有Fe2+的方法是:取样,先滴加KSCN溶液,再滴加________,该过程的现象为________。
(2)步骤②加入过量H2O2的目的是:______________________________________。
(3)步骤③中反应的离子方程式是:_______________________________________。
(4)步骤④中一系列处理的操作步骤:过滤、________、灼烧、________、称量。
(5)若实验中铁无损耗,则每片补血剂中含铁元素的质量为________g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com