
| A. | c(Na+)=c(HS-)+2c(S2-)+c(OH-) | |
| B. | c(H2S)+c(HS-)+c(S2-)=0.1 mol/L | |
| C. | 将上述溶液稀释至0.01 mol/L,c(H+)•c(OH-)不变 | |
| D. | c(S2-)+c(OH-)=c(H+)+c(H2S) |
分析 A.溶液中存在电荷守恒,根据电荷守恒判断;
B.溶液中存在物料守恒,根据物料守恒判断;
C.离子积常数只与温度有关;
D.溶液中存在电荷守恒和物料守恒,根据电荷守恒和物料守恒判断.
解答 解:A.溶液中存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)=c(HS-)+2c(S2-)+c(OH-),故A错误;
B.溶液中存在物料守恒,根据物料守恒得c(H2S)+c(HS-)+c(S2-)=0.1 mol/L,故B正确;
C.离子积常数只与温度有关,温度不变离子积常数不变,则将上述溶液稀释至0.01 mol/L,c(H+)•c(OH-)不变,故C正确;
D.溶液中存在电荷守恒和物料守恒,根据电荷守恒得c(Na+)+c(H+)=c(HS-)+2c(S2-)+c(OH-),根据物料守恒得c(H2S)+c(HS-)+c(S2-)=c(Na+),所以得c(S2-)+c(OH-)=c(H+)+c(H2S),故D正确;
故选A.
点评 本题考查离子浓度大小比较,为高频考点,侧重考查学生对盐类水解的理解及溶液中存在的电荷守恒、物料守恒的灵活运用,灵活运用守恒原理来分析解答即可,题目难度不大.


 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源: 题型:选择题
| A. | C2H2含碳量最高,燃烧生成的CO2最多 | |
| B. | C2H2燃烧时火焰最明亮 | |
| C. | CH4含氢量最高,燃烧生成H2O最多 | |
| D. | CH4、C2H4燃烧生成H2O质量不同,消耗O2不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
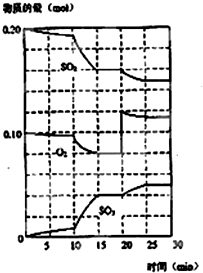 在一定条件下,二氧化硫和氧气发生如图反应:
在一定条件下,二氧化硫和氧气发生如图反应:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
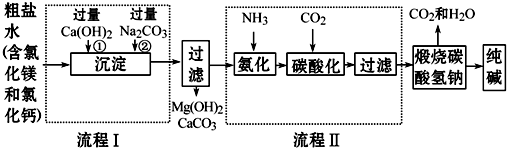
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实 验 事 实 | 结 论 | |
| ① | SO2使酸性高锰酸钾溶液褪色 | 可证明SO2有漂白性 |
| ② | 浓盐酸可除去烧瓶内残留的MnO2,稀硝酸可除去试管内壁的银镜,用磨口玻璃瓶不能保存NaOH溶液 | 都发生了氧化还原反应 |
| ③ | 取少量Na2SO3样品加入Ba(NO3)2溶液后,产生白色沉淀,滴加稀盐酸,沉淀不溶解 | 证明Na2SO3已氧化变质 |
| ④ | 某溶液只含一种溶质,加入稀盐酸产生能使澄清石灰水变浑浊的无色无味气体,向该溶液中滴加BaCl2溶液,有白色沉淀生成 | 确定该溶液中存在CO32- |
| ⑤ | 某无色溶液中加入浓氢氧化钠溶液并加热,产生的气体能使湿润蓝色石蕊试纸变红 | 该溶液一定有NH4+ |
| A. | ①②④⑤ | B. | ①②③⑤ | C. | ①③④⑤ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在密闭容器中加入l.5mol H2和0.5molN2,充分反应后得到NH3分子数为NA | |
| B. | 一定条件下,2.3g的Na完全与O2反应生成3.5g产物时失去的电子数为0.1NA | |
| C. | 1.0L的0.1 mol•L-1Na2CO3溶液中含有的CO32-离子数为0.1NA | |
| D. | 标准状况下,11.2L的CCl4中含有的CCl4分子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com