
【题目】在恒容密闭容器中通入X并发生反应:2X(g)![]() Y(g),温度T1、T2下X的物质的量浓度c(x)随时间t变化的曲线如图所示,下列叙述正确的是
Y(g),温度T1、T2下X的物质的量浓度c(x)随时间t变化的曲线如图所示,下列叙述正确的是
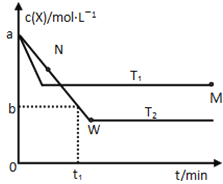
A.该反应进行到M点放出的热量大于进行到W点放出的热量
B.T2下,在0~t1时间内,υ(Y)=![]() mol/(L·min)
mol/(L·min)
C.M点的正反应速率υ正大于N点的逆反应速率υ逆
D.M点时再加入一定量的X,平衡后X的转化率减小
【答案】C
【解析】
A、根据图像可知W点消耗的X的物质的量大于M点消耗X的物质的量,因此根据热化学方程式可知W点放出的热量多,A不正确;B、T2下,在0~t1时间内X的浓度减少了(a-b)mol/L,则根据方程式可知Y的浓度增加了![]() mol。反应速率通常用单位时间内浓度的变化量来表示,所以Y表示的反应速率为
mol。反应速率通常用单位时间内浓度的变化量来表示,所以Y表示的反应速率为![]() mol/(L·min),B不正确;C、根据图像可知,温度为T1时反应首先达到平衡状态。温度高反应速率快,到达平衡的时间少,则温度是T1>T2。M点温度高于N点温度,且N点反应没有达到平衡状态,此时反应向正反应方向进行,即N点的逆反应速率小于N点的正反应速率,因此M点的正反应速率大于N点的逆反应速率,C正确;D、由于反应前后均是一种物质,因此M点时再加入一定量的X,则相当于是增大压强,正反应是体积减小的可逆反应,因此平衡向正反应方向移动,所以X的转化率升高,D不正确.
mol/(L·min),B不正确;C、根据图像可知,温度为T1时反应首先达到平衡状态。温度高反应速率快,到达平衡的时间少,则温度是T1>T2。M点温度高于N点温度,且N点反应没有达到平衡状态,此时反应向正反应方向进行,即N点的逆反应速率小于N点的正反应速率,因此M点的正反应速率大于N点的逆反应速率,C正确;D、由于反应前后均是一种物质,因此M点时再加入一定量的X,则相当于是增大压强,正反应是体积减小的可逆反应,因此平衡向正反应方向移动,所以X的转化率升高,D不正确.
故选C。


科目:高中化学 来源: 题型:
【题目】(1)CS2是一种常用的溶剂,CS2的分子中存在___个σ键。在H—S、H—Cl两种共价键中,键的极性较强的是____,键长较长的是____。
(2)SO2与CO2分子的立体结构分别是______和_____,相同条件下两者在水中的溶解度较大的是______(写分子式),理由是________。
(3)醋酸的球棍模型如图1所示。
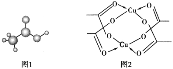
①在醋酸中,碳原子的轨道杂化类型有_____;
②Cu的水合醋酸盐晶体局部结构如图2所示,该晶体中含有的化学键是_____(填选项字母)
A.极性键 B.非极性键 C.配位键 D.金属键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能存在Br-、CO![]() 、SO
、SO![]() 、Al3+、I-、Mg2+、Na+等7种离子中的某几种。现取该溶液进行实验,得到如下现象:
、Al3+、I-、Mg2+、Na+等7种离子中的某几种。现取该溶液进行实验,得到如下现象:
①向溶液中滴加足量氯水后,溶液变橙色,且有无色气泡冒出;
②向所得橙色溶液中加入足量BaCl2溶液,无沉淀生成;
③向所得溶液中继续滴加淀粉溶液,溶液不变蓝色。
已知:5Cl2+I2+6H2O===10HCl+2HIO3
据此可以判断:该溶液肯定不存在的离子组是
A. Al3+、Mg2+、SO![]() B. Mg2+、CO
B. Mg2+、CO![]() 、I-
、I-
C. Al3+、SO![]() 、I- D. Al3+、Br-、SO
、I- D. Al3+、Br-、SO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A. 丙烯的结构简式为CH2CHCH3
B. 新戊烷的二氯代物有2种
C. 分子式为CH4O和C2H6O的物质一定互为同系物
D. 键线式为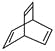 的有机物的分子式为C8H10
的有机物的分子式为C8H10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录如下,则卡片上的描述合理的是( )
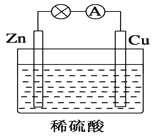
实验后的记录:
①Cu为负极,Zn为正极
②Cu极上有气泡产生,发生还原反应
③SO42-向Cu极移动
④若有0.5mol电子流经导线,则可产生0.25mol气体
⑤电子的流向是:Cu-→Zn
⑥正极反应式:Cu+2e-═Cu2+,发生氧化反应
A.①②③B.②④
C.②④⑥D.③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】HBr被![]() 氧化依次由如下Ⅰ、Ⅱ、Ⅲ三步反应组成:
氧化依次由如下Ⅰ、Ⅱ、Ⅲ三步反应组成:
Ⅰ.HBr(g)+O2(g)=HOOBr(g);
Ⅱ.HOOBr(g)+HBr(g)=2HOBr(g);
Ⅲ.HOBr(g)+HBr(g)=H2O(g)+Br2(g)
1mol HBr(g)被氧化为![]() (g)放出
(g)放出![]() 热量,其能量与反应进程的关系如图所示:
热量,其能量与反应进程的关系如图所示:
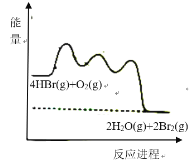
下列说法正确的是![]()
![]()
A.反应Ⅰ、Ⅱ、Ⅲ均为放热反应
B.Ⅰ的反应速率最慢
C.HOOBr比HBr和![]() 稳定
稳定
D.热化学方程式为:4HBr(g)+O2(g)=2H2O(g)+2Br2(g) ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如右,电解总反应为:2Cu+H2O![]() Cu2O+H2↑。下列说法正确的是
Cu2O+H2↑。下列说法正确的是

A. 石墨电极上产生氢气
B. 铜电极发生还原反应
C. 铜电极接直流电源的负极
D. 当有0.1 mol电子转移时,有0.1 mol Cu2O生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D、E五种阴阳离子均不相同的化合物,五种阳离子为![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() ,五种阴离子为
,五种阴离子为![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 现将它们分别配成
现将它们分别配成![]() 的溶液,进行如下实验
的溶液,进行如下实验
![]() 测得溶液A、B呈碱性,且碱性为
测得溶液A、B呈碱性,且碱性为![]() ;
;
![]() 向C溶液中滴加稀盐酸,有气体生成;
向C溶液中滴加稀盐酸,有气体生成;
![]() 向D溶液中滴加NaOH溶液,先岀现沉淀,继续滴加,沉淀消失
向D溶液中滴加NaOH溶液,先岀现沉淀,继续滴加,沉淀消失
请根据上述实验现象,回答下列问题
![]() 实验
实验![]() 中发生反应的化学方程式为______________;向C中滴加NaOH溶液,出现的现象为_________。
中发生反应的化学方程式为______________;向C中滴加NaOH溶液,出现的现象为_________。
![]() 分两步写出实验
分两步写出实验![]() 中发生反应的离子方程式______________。
中发生反应的离子方程式______________。
![]() 写出下列四种化合物的化学式:A______________;B______________。
写出下列四种化合物的化学式:A______________;B______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有pH均为2的盐酸、硫酸、醋酸三瓶溶液
(1)设三种溶液的物质的量浓度依次为c1、c2、c3,则其关系是________________________(用“>、<、=”表示,下同)。
(2)取同体积的三种酸分别加蒸馏水稀释到pH=6,需水的体积依次为V1、V2、V3,则其关系是___________________________。
(3)完全中和体积和物质的量浓度均相同的三份NaOH溶液时,需三种酸的体积依次为V1、V2、V3,则其关系是____________________________。
(4)取同体积的酸的溶液分别加入足量的锌粉,反应过程中放出H2的速率依次为a1、a2、a3,则其关系是___________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com