
相同条件下,如果1 mol氢原子所具有的能量为E1,1mol氢分子的能量为E2。下列关系中正确的是
A.2E1=E2 B.2E1>E2 C.2E1<E2 D.E1=E2
科目:高中化学 来源:2014-2015河北枣强中学高一上学期期末考试化学试卷(解析版) 题型:选择题
有A、B、C、D四种金属,分别把它们加入到稀盐酸中,A、B、D反应后有气体放出,C无明显现象,再把A、D加入B盐溶液中,D表面有B析出,而A没有,则四种金属的活动性顺序是为
A.A>B>D>C B.B>D>A>C C.D>A>B>C D.D>B>A>C
查看答案和解析>>
科目:高中化学 来源:2014-2015河北枣强中学高二上学期期末考试化学试卷(解析版) 题型:选择题
室温下,某溶液中由水电离出来的c(OH-)=10-12mol·L-1,则该溶液的溶质不可能是
A.HCl B.NaOH C.NH4NO3 D.H2SO4
查看答案和解析>>
科目:高中化学 来源:2014-2015河北邢台一中高一3月月考化学试卷(解析版) 题型:选择题
向足量H2SO4溶液中加入100 mL 0.4 mol·L-1 Ba(OH)2溶液,放出的热量是5.12 kJ。如果向足量Ba(OH)2溶液中加入100 mL 0.4 mol·L-1盐酸时,放出的热量为2.2 kJ。则Na2SO4溶液与BaCl2溶液反应的热化学方程式为
A.Ba2+(aq)+SO42-(aq)=BaSO4(s) ΔH=-2.92 kJ·mol-1
B.Ba2+(aq)+SO42-(aq)=BaSO4(s) ΔH=-18 kJ·mol-1
C.Ba2+(aq)+SO42-(aq)=BaSO4(s) ΔH=-73 kJ·mol-1
D.Ba2+(aq)+SO42-(aq)=BaSO4(s) ΔH=-0.72 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2014-2015河北邢台一中高一3月月考化学试卷(解析版) 题型:选择题
已知Fe(s)+H2SO4(aq)=FeSO4(aq)+H2(g) ΔH<0,则下列关于该反应的叙述不正确的是
A.化学键的断裂和形成是化学反应中能量变化的主要原因
B.上述热化学方程式中的ΔH的值与反应物的用量有关
C.该反应的化学能可以转化为电能
D.此反应构成的原电池中,正极可以是碳棒、铜或锌
查看答案和解析>>
科目:高中化学 来源:2014-2015河北邢台一中高一3月月考化学试卷(解析版) 题型:选择题
下列各组的电极材料和电解液,不能组成原电池的是
A.铜片、石墨棒,稀硫酸 B.铜片、石墨棒,硝酸银溶液
C.锌片、铜片,稀盐酸 D.铜片、银片,FeCl3溶液
查看答案和解析>>
科目:高中化学 来源:2014-2015河北唐山市高一下学期开学调研考试化学试卷(解析版) 题型:填空题
(7分)铜既能与稀硝酸反应,也能与浓硝酸反应,当铜与一定浓度硝酸反应时,可将方程式表示为:Cu+HNO3→Cu(NO3)2+NO↑+NO2↑+H2O (方程式未配平)
(1)硝酸在该反应中表现出的性质是_____________________。
(2)0.4molCu被硝酸完全溶解后,硝酸得到的电子数是________,如果得到的NO和NO2物质的量相同,则参加反应的硝酸的物质的量是________mol。
(3)0.3molCu被另一浓度的硝酸完全溶解后,如果此时产生的NO和NO2气体总体积在标准状况下为8.96 L,则被还原的硝酸的物质的量是_______mol,参加反应的硝酸的物质的量是______mol,产生的混合气体中NO和NO2体积比为_______。
查看答案和解析>>
科目:高中化学 来源:2014-2015河北唐山市高一下学期开学调研考试化学试卷(解析版) 题型:选择题
将等体积的NO2和N2的混合气体置于试管中,并将试管倒立于水槽中,充分反应后,剩余气体的体积约为原总体积的
A.1/2 B.2/3 C.1/3 D.1/6
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津市高三联考一化学试卷(解析版) 题型:填空题
(14分)燃煤和汽车尾气是造成空气污染产生雾霾的原因之一。消除汽车尾气是减少城市空气污染的热点研究课题。
(1)已知:①N2(g)+O2(g)=2NO(g) △H=+180.5kJ·mol-1
②CO(g)+1/2 O2(g)=CO2 (g) △H=-283kJ·mol-1
则汽车尾气中NO和CO在催化转化器中相互反应成无污染的气体的热化学方程式是_______________。
(2)在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。
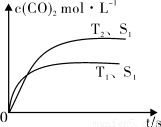
已知当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若催化剂的表面积S1>S2,在上图中画出c(CO2)在T2、S2条件下达到平衡过程中的变化曲线。
(3)在一定温度下,将2.0mol NO、2.4mol气体CO通入到固定容积为2L的容器中,反应过程中部分物质的浓度变化如图所示:
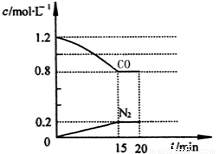
①有害气体NO的转化率为__________,0~15min NO的平均速率v(NO)=__________mol/(L·min)。(保留两位有效数字)
②20min时,若改变反应条件,导致CO浓度减小,则改变的条件可能是________(选填序号)。
a.缩小容器体积 b.增加CO的量
c.降低温度 d.扩大容器体积
③若保持反应体系的温度不变,20min时再向容器中充入NO、N2各0.4mol,化学平衡将______移动(选填“向左”、“向右”或“不”),移动后在达到平衡时的平衡常数的值是_______(保留两位有效数字)。
(4)汽车尾气中的SO2和过氧化氢可设计成酸性原电池,请写出它的正极反应的方程式__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com