
| A. | 常温下,将pH=2的盐酸和pH=12的氨水等体积混合:c(NH4+)>c(Cl-)>c(OH-)>c(H+) | |
| B. | 0.1mol•L-1 Na2CO3溶液:2c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3) | |
| C. | 相同温度下,0.6 mol/L氨水溶液与0.3 mol/L氨水溶液中c(OH-)之比是2:1 | |
| D. | 物质的量浓度相等的①NH4HSO4溶液、②NH4HCO3溶液、③NH4Cl溶液中,c(NH4+)的大小关系:①>②>③ |
分析 A.混合液中氨水过量,混合液呈碱性,则c(OH-)>c(H+),结合电荷守恒判断铵根离子和氯离子浓度;
B.根据碳酸钠溶液中的物料守恒判断;
C.氨水浓度越大,一水合氨的电离程度越小,据此判断溶液中氢氧根离子浓度之比;
D.碳酸氢根离子促进铵根离子水解、氢离子抑制铵根离子水解,则硫酸氢铵溶液中铵根离子浓度最大,碳酸氢铵溶液中铵根离子浓度最小.
解答 解:A.常温下,将pH=2的盐酸和pH=12的氨水等体积混合,氨水为弱碱,则氨水过量,混合液呈碱性:c(OH-)>c(H+),根据电荷守恒可知:c(NH4+)>c(Cl-),溶液中离子浓度大小为:c(NH4+)>c(Cl-)>c(OH-)>c(H+),故A正确;
B.0.1mol•L-1Na2CO3溶液中,根据物料守恒可得:c(Na+)=2c(HCO3-)+2c(CO32-)+2c(H2CO3),故B错误;
C.相同温度下,0.6 mol/L氨水溶液与0.3 mol/L氨水溶液中,前者一水合氨的电离程度减小,则两溶液中c(OH-)之比小于2:1,故C错误;
D.碳酸氢根离子促进铵根离子水解、氢离子抑制铵根离子水解,则物质的量浓度相等时①NH4HSO4溶液中铵根离子浓度最大,②NH4HCO3溶液中铵根离子浓度最小,即三种溶液中c(NH4+)的大小关系为:①>③>②,故D错误;
故选A.
点评 本题考查了离子浓度大小比较,题目难度中等,涉及盐的水解原理、弱电解质的电离及其影响、离子浓度大小比较等知识,明确电荷守恒、物料守恒的含义为解答关键,试题培养了学生的分析能力及灵活应用能力.


 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:选择题
| A. | 吸热反应在一定条件下可自发进行,放热反应在任何条件下都可以自发进行 | |
| B. | 有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大 | |
| C. | 升高温度能使化学反应速率增大主要原因是增加了反应物分子中活化分子的百分数 | |
| D. | 升高温度或加入催化剂,可以改变化学反应的反应热 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 选用100mL容量瓶,并用蒸馏水洗净后烘干 | |
| B. | 称取5.9g NaCl固体倒入容量瓶中溶解 | |
| C. | 定容时俯视刻度会导致浓度偏高 | |
| D. | 摇匀、静置后发现凹液面低于刻度线1~2mm,用胶体滴管加水至与刻度线相平即可 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝元素是地壳中含量最多的元素 | |
| B. | 工业炼铝采用电解熔融的铝土矿的方法 | |
| C. | 冰晶石能使氧化铝熔融温度降低 | |
| D. | 工业上可用电解熔融氯化铝制取金属铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
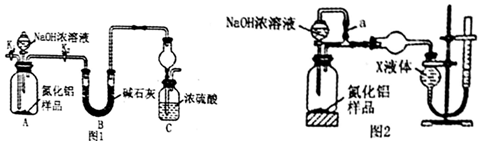
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有②④⑥ | B. | 只有③④⑥ | C. | 只有①③⑤ | D. | 只有①②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 硅酸盐一般不溶于水,它是水泥、陶瓷、玻璃的主要成分 | |
| B. | SiO2与CO2相似,由一个硅原子和两个氧原子构成一个SiO2分子 | |
| C. | SiO2是酸性氧化物,能与水反应生成硅酸 | |
| D. | 硅元素是构成矿物岩石的主要成分之一,其化合态几乎全部是氧化物和硅酸盐 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com