
| X |
| X |
| H2O |
| 44.8L |
| 22.4L/mol |
| 84g |
| 1.5mol |
| X |
| X |
| H2O |
| 44.8L |
| 22.4L/mol |
| 84g |
| 1.5mol |
| ||
| ||
| X |
| X |
| H2O |
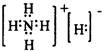 ,NH5分子中负一价的氢有强还原性,要与水中正一价的氢发生归中反应生成氢气,
,NH5分子中负一价的氢有强还原性,要与水中正一价的氢发生归中反应生成氢气, ;能;NH4H中-1价的H与H2O中+1价的H发生归中反应;
;能;NH4H中-1价的H与H2O中+1价的H发生归中反应;

 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:
| A、浓硫酸和浓硝酸都不能用来直接跟锌粒反应制氢气 |
| B、浓硫酸和浓硝酸都能与单质碳反应 |
| C、浓硫酸和浓硝酸加水稀释后都能与金属铜反应 |
| D、浓硫酸和浓硝酸在常温下都能用金属铝制容器盛放 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
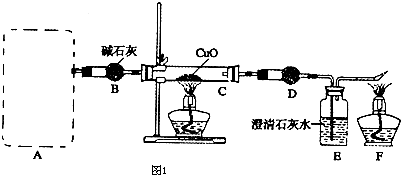
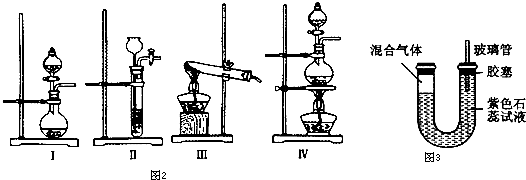
查看答案和解析>>
科目:高中化学 来源: 题型:
 化学能转变成热能、化学能转变成电能是能量转化的重要形式.
化学能转变成热能、化学能转变成电能是能量转化的重要形式.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境 |
| B、催化转化机动车尾气为无害气体,能消除酸雨和雾霾的发生 |
| C、研发高效低毒的农药,降低蔬菜的农药残留量 |
| D、积极开发废电池的综合利用技术,防止电池中的重金属等污染土壤和水体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在元素周期表里,元素所在主族的族序数等于其原子核外最外层电子数 |
| B、在元素周期表里,元素所在的周期数等于原子电子层数 |
| C、最外层电子数为8的微粒是稀有气体元素的原子 |
| D、同主族元素的原子序数越大,其原子半径越大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com