
下列有关说法中正确的是 ( )
A.第一电离能越大的原子越容易得到电子 B.同周期元素从左到右第一电离能一定增大
C.同周期元素电负性从左到右越来越大 D.金属元素的电负性一定小于非金属元素
科目:高中化学 来源: 题型:
草酸晶体的组成可表示为H2C2O4•xH2O.实验室常用其加热分解制取CO气体,反应方程式为:H2C2O4•xH2O  CO+CO2+(x+1)H2O.下图为分解草酸晶体,用干燥纯净的CO还原CuO制取Cu,并收集CO的实验装置(略去铁架台、铁夹等支撑加持装置),回答下列问题.
CO+CO2+(x+1)H2O.下图为分解草酸晶体,用干燥纯净的CO还原CuO制取Cu,并收集CO的实验装置(略去铁架台、铁夹等支撑加持装置),回答下列问题.
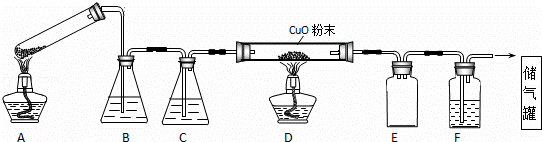
(1)A装置为加热分解草酸的装置,该装置错误是 试管口应向上倾斜(或应向下倾斜) ,C装置中盛放的试剂是 浓硫酸 (填化学式),E装置的作用是 安全瓶(或防倒吸) .
(2)实验过程中涉及到如下操作:①点燃A处的酒精灯 ②熄灭A处的酒精灯 ③点燃D处的酒精灯 ④熄灭D处的酒精灯.这4步操作由先到后的顺序为 ①③④② (填序号).点燃D处酒精灯前必须要进行的操作名称是 验纯 .
(3)用酸性高锰酸钾溶液滴定草酸晶体,求x的值.
实验步骤:准确称取1.17g 草酸晶体,配成100mL溶液;取出20.00mL于锥形瓶中,再向瓶中加入足量稀H2SO4;用0.0500mol/L酸性高锰酸钾溶液滴定,滴定至终点时消耗高锰酸钾溶液16.00mL.滴定时,所发生的反应为:2MnO4﹣+5H2C2O4+6H+=10CO2+2Mn2++8H2O.
①配制草酸溶液除需要玻璃棒、烧杯,还一定需要的玻璃仪器有 100mL容量瓶、胶头滴管 .
②x= 1.5 .
(4)为探究催化剂对化学反应速率的影响,在甲乙试管中分别加入下列物质
| 试管 | 0.01mol/L KMnO4 | 0.1mol/L H2C2O4 | 0.1mol/L H2SO4 | MnSO4固体 |
| 甲 | 4mL | x mL | 1mL | 无 |
| 乙 | y mL | 2mL | 1mL | 有 |
则x= 2 ,y= 4 .能够得出催化剂对该反应有影响结论的实验现象是 加入MnSO4固体的试管中溶液褪色速率比未加的快 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是
A.乙酸溶液中存在乙酸分子,能证明乙酸是一种弱酸。
B.丙醛和乙醛都有醛基,都能和银氨溶液、新制氢氧化铜反应。
C.除去工业乙醇中少量水常加入生石灰,并蒸馏。
D.油脂、淀粉、蛋白质、纤维素属于天然高分子化合物。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知aAn+、bB(n+1)+、cCn-、dD(n+1)-均具有相同的电子层结构,关于A、B、C、D四种元素的叙述正确的是
A.原子半径:A>B>C>D B.离子半径:D(n+1)->Cn->B(n+1)+>An+
C.原子序数:b>a>c>d D.金属性:B>A,气态氢化物稳定性:D>C
查看答案和解析>>
科目:高中化学 来源: 题型:
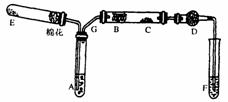 下图为某化学兴趣小组设计的乙醇氧化的实验装置(图中加热仪器、铁架台、铁夹等均未画出)。图中:A为无水乙醇(沸点为78℃),B为绕成螺旋状的细铜丝或银丝,C为无水CuSO4粉末,D为碱石灰,F为新制的碱性Cu(OH)2悬浊液。
下图为某化学兴趣小组设计的乙醇氧化的实验装置(图中加热仪器、铁架台、铁夹等均未画出)。图中:A为无水乙醇(沸点为78℃),B为绕成螺旋状的细铜丝或银丝,C为无水CuSO4粉末,D为碱石灰,F为新制的碱性Cu(OH)2悬浊液。
请回答下列问题:
(1) 如图所示连接好装置后,在加入试剂之前,应先 ____ 。(操作名称)
(2)在上述装置中,实验时需要加热的仪器为(填仪器或某部位的代号) 。
为使A中乙醇平缓均匀的气化成乙醇蒸气,常采用的操作方法是 。
(3)图中D处使用碱石灰的作用是 。
(4)C处观察到的现象是 ,
F中观察到的现象是 ,
说明B处发生的反应方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
根据相关的化学原理,下列判断正确的是 ( )
A.由于水中存在氢键,所以稳定性:H2O>H2S
B.由于二氧化硅的相对分子质量比二氧化碳的大,所以沸点:SiO2>CO2 C.若A2 + 2D— == 2A— + D2,则氧化性D2>A2
D.若R2—和M+的电子层结构相同,则离子半径R2—>M+
查看答案和解析>>
科目:高中化学 来源: 题型:
向含有1mol配合物[Co(NH3)5Cl]Cl2的溶液中加入足量的硝酸银溶液,得到的沉淀物质的量为( )
A.1mol B.1.5mol C.2mol D.3mol
查看答案和解析>>
科目:高中化学 来源: 题型:
镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成.为实现资源的回收利用并有效防止环境污染,设计如下工艺流程:
已知:①NiCl2易溶水,Fe3+不能氧化Ni2+
②该温度下一些难溶物的Ksp及沉淀析出的理论pH如下表所示:
| Ksp | 开始沉淀pH | 沉淀完全pH |
| |
| Al(OH)3 | 1.9×10-33 | 3.43 | 4.19 | |
| Fe(OH)3 | 3.8×10-38 | 2.53 | 2.94 | |
| Ni(OH)2 | 1.6×10-14 | 7.60 | 9.75 | |
| NiC2O4 | 4.0×10-10 | —— | —— |
回答下列问题:
(1)该工艺流程中多次重复利用的一种实验基本操作是 。
(2)步骤①所留残渣的主要成分为 (填物质名称)
(3)根据上表数据判断步骤②依次析出沉淀Ⅱ______和沉淀Ⅲ______(填化学式),
控制两种沉淀析出可利用 。
A.pH试纸 B.石蕊指示剂 C.pH计
(4)已知实验温度时的溶解度:NiC2O4>NiC2O4•H2O>NiC2O4•2H2O,则步骤③的化学反应方程式是 。
(5)C可被E氧化,写出步骤④的离子反应方程式 。
(6)FeCl3和AlCl3 的混合溶液中加入NaOH溶液,若Fe(OH)3和Al(OH)3同时存在,则c(Fe3+)/c(Al3+)= 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com