
分析 ①HCl不溶于水,食盐水可抑制氯气的溶解;
②HCl与饱和亚硫酸氢钠反应生成二氧化硫;
③HCl与饱和碳酸氢钠反应生成二氧化碳;
④SO2与饱和碳酸氢钠反应生成二氧化碳.
解答 解:①HCl不溶于水,食盐水可抑制氯气的溶解,则利用饱和食盐水、洗气可除杂,
答:饱和食盐水、洗气可除杂;
②HCl与饱和亚硫酸氢钠反应生成二氧化硫,则利用饱和亚硫酸氢钠、洗气可除杂,
答:饱和亚硫酸氢钠、洗气可除杂;
③HCl与饱和碳酸氢钠反应生成二氧化碳,则利用饱和碳酸氢钠、洗气可除杂,
答:饱和碳酸氢钠、洗气可除杂;
④SO2与饱和碳酸氢钠反应生成二氧化碳,则利用饱和碳酸氢钠、洗气可除杂,
答:饱和碳酸氢钠、洗气可除杂.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、发生的反应及混合物分离提纯方法为解答的关键,侧重分析与实验能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 7.1gCl2与足量的氢氧化钠溶液反应转移的电子数一定为0.2NA | |
| B. | 在常温常压下,11.2 升氯气含有的分子数为0.5NA | |
| C. | 常温常压下,32 g O2和O3的混合气体所含原子数为2NA | |
| D. | 1 molFe与足量的Cl2反应转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在含等物质的量的Fe2+、Ag+、Cu2+、H+的溶液中加入Zn:Ag+、Cu2+、H+、Fe2+ | |
| B. | 在含等物质的量的AlO2-、OH-、CO32-溶液中,逐滴加入盐酸:AlO2-、Al(OH)3、OH-、CO32- | |
| C. | 在含等物质的量的Ba(OH)2、KOH的溶液中通入CO2:KOH、Ba(OH)2、BaCO3 | |
| D. | 在含等物质的量的FeBr2、FeI2的溶液中缓慢通入Cl2:I-、Br-、Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向AgCl的悬浊液中加入NaBr溶液,白色沉淀转化为淡黄色,说明KSP(AgCl)<KSP(AgBr) | |
| B. | 将0.001mol•L-1 AgNO3溶液滴入0.001mol•L-1 KCl和0.001mol•L-1 K2CrO4混合溶液中,先产生Ag2CrO4沉淀 | |
| C. | 向AgCl的悬浊液中滴加浓氨水,沉淀溶解,说明AgCl的溶解平衡向右移动 | |
| D. | 测定水体中氯化物的含量,常用标准硝酸银法进行滴定,滴定时,应加入的指示剂为K2S |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 (1,3-环己二烯)的各步反应方程式
(1,3-环己二烯)的各步反应方程式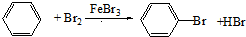
 +3H2$\stackrel{一定条件下}{→}$
+3H2$\stackrel{一定条件下}{→}$
 +NaOH$→_{△}^{乙醇}$
+NaOH$→_{△}^{乙醇}$ +H2O+NaBr
+H2O+NaBr +Br2→
+Br2→
 +2NaOH$→_{△}^{乙醇}$
+2NaOH$→_{△}^{乙醇}$ +2NaBr+2H2O.
+2NaBr+2H2O.查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省高二上第三次月考化学卷(解析版) 题型:选择题
可逆反应2SO2(g)+O2(g) 2SO3(g)△H<0,在一定条件下达到平衡状态,时间为t1时改变条件.化学反应
2SO3(g)△H<0,在一定条件下达到平衡状态,时间为t1时改变条件.化学反应 速率与反应时间的关系如图所示.下列说法正确的是
速率与反应时间的关系如图所示.下列说法正确的是
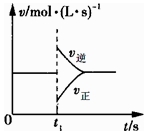
A.维持温度、容积不变,t1时充入SO3(g)
B.维持压强不变,t1时升高反应体系温度
C.维持温度、容积不变,t1时充入一定量Ar
D.维持温度、压强不变,t1时充入SO3(g)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上第一次月考化学卷(解析版) 题型:选择题
将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s) 2NH3(g)+CO
2NH3(g)+CO 2(g)。不能判断该分解反应已经达到化学平衡的是
2(g)。不能判断该分解反应已经达到化学平衡的是
A.密闭容器中二氧 化碳的体积分数不变
化碳的体积分数不变
B.密闭容器中混合气体的密度不变
C.密闭容器中气体的总物质的量不变
D. v(NH3)正=2v(CO2)逆
v(NH3)正=2v(CO2)逆
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com