
| A. | 在共价化合物中一定含有共价键 | |
| B. | 由非金属元素组成的化合物一定是共价化合物 | |
| C. | 含有离子键的化合物一定是离子化合物 | |
| D. | 双原子单质分子中的共价键一定是非极性键 |
分析 A、只含有共价键的化合物是共价化合物;
B、全部由非金属元素组成的化合物可能是离子化合物,离子化合物一定含有离子键;
C、离子化合物一定含有离子键;
D、同种元素形成的纯净物是单质,而同种元素的原子形成的共价键是非极性共价键.
解答 解:A、只含有共价键的化合物是共价化合物,所以在共价化合物中一定含有共价键,故A正确;
B、全部由非金属元素组成的化合物可能是离子化合物,如氯化铵中只含有非金属元素,但氯化铵是离子化合物,故B错误;
C、离子化合物一定含有离子键,所以含有离子键的化合物是离子化合物,故C正确;
D、同种元素形成的纯净物是单质,而同种元素的原子形成的共价键是非极性共价键,故D正确;
故选B.
点评 本题考查了化学键和化合物的关系,难度不大,注意全部由非金属元素组成的化合物可能是离子化合物,由金属元素和非金属元素组成的化合物可能是共价化合物,如氯化铝.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3-CH=CH2和CH3-CH2-CH=CH2 | B. | CH3-CH3和CH3-CH=CH2 | ||
| C. | CH3-CH2-CH3和CH3-CH=CH2 | D. | CH3-CH2-CH2-CH3和CH3-CH2-CHCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
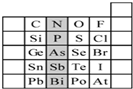 元素在周期表中的位置,反映了元素的原子结构和元素的性质.下图是元素周期表的一部分.请用元素符号或化学式填空:
元素在周期表中的位置,反映了元素的原子结构和元素的性质.下图是元素周期表的一部分.请用元素符号或化学式填空:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 沸点由高到低:癸烷、正已烷、新戊烷、正戊烷 | |
| B. | 酸性高锰酸钾溶液既可以鉴别甲烷和乙烯,又可以用来除去甲烷中的少量乙烯 | |
| C. | 乙烯的化学性质比乙烷活泼,可作香蕉等水果的催熟剂 | |
| D. | 苯可以通过石油分馏或煤焦油的催化重整获得 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素性质 | 元素编号 | |||||||
| A | B | C | D | E | F | G | H | |
| 原子半径(nm) | 0.102 | 0.117 | 0.074 | 0.110 | 0.071 | 0.075 | 0.077 | 0.099 |
| 最高化合价 | +6 | +4 | +5 | +5 | +4 | +7 | ||
| 最低化合价 | -2 | -4 | -2 | -3 | -1 | -3 | -4 | -1 |
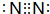 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
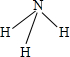 ,它的共价键属于极性(填“极性”或“非极性”)键;含有离子键和非极性共价键的化合物的电子式为
,它的共价键属于极性(填“极性”或“非极性”)键;含有离子键和非极性共价键的化合物的电子式为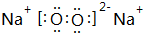 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ④⑥ | B. | ②④⑥ | C. | 仅有⑥ | D. | ①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com