
【题目】CalanolideA是一种抗HTV药物,其结构简式如下图所示。下列关于CalanolideA的说法错误的是

A.分子式为C22H24O5
B.分子中有3种含氧官能团
C.该物质既可发生消去反应又可发生加成反应
D.1mol该物质与足量NaOH溶液反应时消耗1molNaOH
 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:
【题目】W、X、Y、Z四种短周期元素,在元素周期表中的位置如图所示,其中W元素的原子序数为Z元素原子序数的两倍,则下列说法正确的是
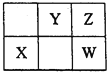
A. X位于元素周期表中的第3周期第ⅥA族
B. X、Y、Z三种元素对应原子的半径依次减小
C. XZ2和YZ2的结构和化学性质相似
D. 利用Y的含氧酸酸性强于W的含氧酸酸性,可证明非金属性W强于Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D为石墨电极,E、F分别为短周期相邻两种活泼金属中的一种,且E能与NaOH溶液反应。按图示接通线路,反应一段时间。
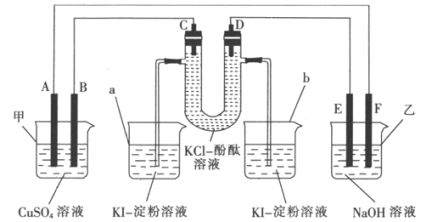
(1)判断装置的名称:甲池为_________(填“电解池”或“原电池”,下同),乙池为_________。
(2)B极为_________ (填“正极”或“负极”或“阳极”或“阴极”,下同),电极反应式为_________;F极为_________,电极反应式为__________________。
(3)U形管中溶液先变红的是_________(填“C”或“D”)极,U形管中发生反应的化学方程式为________________________________________。
(4)当烧杯中有38.1 g I2(KI足量)生成时,甲池中溶液的质量会减少________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列生活应用实例中,涉及氧化还原反应的是
A. 用白醋去除水垢
B. 用热的纯碱溶液清洗油污
C. 用风油精(含石蜡油)清洗透明胶残胶
D. 补铁剂(有效成分为Fe2+)与含维生素C共服效果更佳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知断裂1mol化学键吸收的能量或形成1mol化学键释放的能量称为键能,部分物质的键能如下表所示:甲醛结构式为:![]() ,甲醛制备乌洛托品(C6H12N4)的反应如下,该反应的△H为( )
,甲醛制备乌洛托品(C6H12N4)的反应如下,该反应的△H为( )
6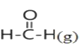 +4NH3(g)→
+4NH3(g)→ +6H2O(l)
+6H2O(l)
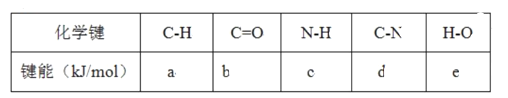
A. 6(a+b+c-d-e) kJ·mol-1B. 6(d+e-a-b-c) kJ·mol-1
C. 6(b+2c-2d-2e) kJ·mol-1D. 6(2d+2a+2e-b-3c) kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:X(g)+3Y(g)![]() 2Z(g),一定条件下,0.3 mol X(g)与0.3 mol Y(g)在体积为1 L的密闭容器中发生反应。下列图示合理的是
2Z(g),一定条件下,0.3 mol X(g)与0.3 mol Y(g)在体积为1 L的密闭容器中发生反应。下列图示合理的是
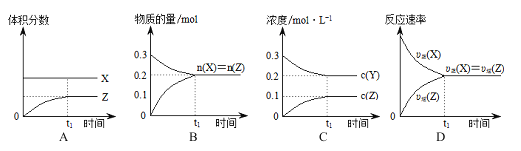
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.6molA和0.5molB充入0.4L密闭容器中发生2A(g)+B(g)![]() mD(g)+E(g),经过5min后达到化学平衡,此时测得D为0.2mol。又知5min内用E表示的平均反应速率为0.1mol·L-1·min-1,计算:
mD(g)+E(g),经过5min后达到化学平衡,此时测得D为0.2mol。又知5min内用E表示的平均反应速率为0.1mol·L-1·min-1,计算:
(1)m的值___________;
(2)平衡时B的转化率____________;
(3)起始与平衡时密闭容器中的压强之比_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请运用化学反应原理的相关知识回答下列问题:
(1)焦炭可用于制取水煤气。测得12 g 碳与水蒸气完全反应生成水煤气时,吸收了131.6 kJ热量。该反应的热化学方程式为_________________。该反应的△S ________0(选填“>”、“<”或“=”),该反应在_______条件下能自发进行(选填“高温”、“低温”或“任意温度”)。
(2)CO是有毒的还原性气体,工业上有重要的应用。 CO是高炉炼铁的还原剂,其主要反应为:Fe2O3(s)+3CO(g) ![]() 2Fe(s)+3CO2(g) ΔH = a kJ mol-1
2Fe(s)+3CO2(g) ΔH = a kJ mol-1
①已知: Fe2O3(s)+3C(石墨) = 2Fe(s)+3CO(g) ΔH1 = + 489.0 kJ mol-1 C(石墨)+CO2(g) = 2CO(g) ΔH2 = + 172.5 kJ mol-1则a =____________。
②工业上高炉炼铁反应的平衡常数表达式K =______,温度升高后,K值_______(选填“增大”、“不变”或“减小”)。
③在T ℃时,该反应的平衡常数K = 64,在恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
Fe2O3 | CO | Fe | CO2 | |
甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
下列说法正确的是____________(填字母)
a.若容器内气体密度恒定时,标志反应达到平衡状态
b.甲容器中CO的平衡转化率为60%,大于乙
c.甲、乙容器中,CO的平衡浓度之比为2∶3
d.由于容器的体积未知,所以无法计算该条件下甲容器中CO的平衡转化率
(3)请解释打开饮料“雪碧”的瓶盖,会有大量气泡冒出的原因:_____________.
(4)甲醇(CH3OH)燃料电池是以铂为电极,以KOH溶液为电解质溶液,在两极区分别加入CH3OH和O2即可产生电流。正极加入的物质是______;负极的电极反应是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧熔融碳酸盐燃料电池是一种高温电池(600~700℃),具有效率高、噪音低、无污染、燃料多样、余热利用价值高等优点。氢氧熔融碳酸盐燃料电池的工作原理如图所示。下列有关该电池的说法正确的是
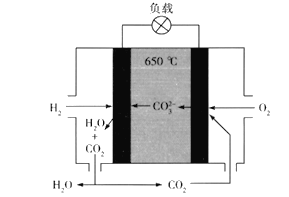
A. 电池工作时,熔融碳酸盐只起到导电的作用
B. 负极反应式为H2 -2e- +CO32-==CO2+H2O
C. 该电池可利用工厂中排出的CO2,减少温室气体的排放
D. 电池工作时,外电路中流过0.2 mol电子,消耗3.2 g O2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com