
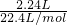 =0.1mol,令NO与H2的物质的量分别为xmol、ymol,则:
=0.1mol,令NO与H2的物质的量分别为xmol、ymol,则: =13.2,联立方程,解得x=0.04,y=0.06,
=13.2,联立方程,解得x=0.04,y=0.06, =0.4,
=0.4, =0.08mol,故m(Al)=0.08mol×27g/mol=2.16g,
=0.08mol,故m(Al)=0.08mol×27g/mol=2.16g,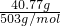 =0.09mol,由铝元素守恒可知,2n(Al2O3)+0.08mol=0.09mol,故n(Al2O3)=0.005mol,
=0.09mol,由铝元素守恒可知,2n(Al2O3)+0.08mol=0.09mol,故n(Al2O3)=0.005mol, =0.045mol,故m[(NH4)2SO4]=0.045mol×132g/mol=5.94g,根据硫酸根守恒可知n(H2SO4)=0.09mol×2-0.045mol=0.135mol,故m(H2SO4)=0.135×98g,
=0.045mol,故m[(NH4)2SO4]=0.045mol×132g/mol=5.94g,根据硫酸根守恒可知n(H2SO4)=0.09mol×2-0.045mol=0.135mol,故m(H2SO4)=0.135×98g,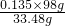 =0.395,
=0.395, =0.05mol,由氧原子守恒n(Al3+)=2n(Al2O3)=0.1mol,
=0.05mol,由氧原子守恒n(Al3+)=2n(Al2O3)=0.1mol, 计算混合气体的物质的量,令NO与H2的物质的量分别为xmol、ymol,根据二者物质的量之和与平均摩尔质量列方程计算x、y的值,进而计算NO的体积分数;
计算混合气体的物质的量,令NO与H2的物质的量分别为xmol、ymol,根据二者物质的量之和与平均摩尔质量列方程计算x、y的值,进而计算NO的体积分数; 计算40.77g铝铵矾晶体的物质的量,利用铝元素守恒计算n(Al2O3);
计算40.77g铝铵矾晶体的物质的量,利用铝元素守恒计算n(Al2O3); 计算5.1g氧化铝的物质的量,由铝原子守恒n(Al3+)=2n(Al2O3),加入足量的盐酸,固体完全溶解,生成0.1mol气体为二氧化碳,所得溶液中加入足量的NaOH并微热,又生成0.1mol气体为氨气,根据元素守恒计算n(CO32-)、n(NH4+),由电荷守恒与质量守恒判断是否缺少阴离子,据此判断化学式,书写方程式.
计算5.1g氧化铝的物质的量,由铝原子守恒n(Al3+)=2n(Al2O3),加入足量的盐酸,固体完全溶解,生成0.1mol气体为二氧化碳,所得溶液中加入足量的NaOH并微热,又生成0.1mol气体为氨气,根据元素守恒计算n(CO32-)、n(NH4+),由电荷守恒与质量守恒判断是否缺少阴离子,据此判断化学式,书写方程式.

科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2013届福建省四地六校高三第三次月考化学试卷(带解析) 题型:单选题
下列说法正确的是
| A.浓硫酸、浓硝酸、稀硝酸都是氧化性酸,常温下都能使金属铝钝化 |
| B.浓硫酸与蔗糖混合搅拌产生有刺激性气味的气体,此过程只体现了浓硫酸的脱水性 |
| C.往某溶液中加盐酸产生能使澄清石灰水变浑浊的气体,说明该溶液中一定含CO32-或SO32- |
| D.向某溶液中滴加BaCl2溶液,产生不溶于稀硝酸的白色沉淀,不能说明该溶液中一定含SO42- |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年福建省四地六校高三第三次月考化学试卷(解析版) 题型:选择题
下列说法正确的是
A.浓硫酸、浓硝酸、稀硝酸都是氧化性酸,常温下都能使金属铝钝化
B.浓硫酸与蔗糖混合搅拌产生有刺激性气味的气体,此过程只体现了浓硫酸的脱水性
C.往某溶液中加盐酸产生能使澄清石灰水变浑浊的气体,说明该溶液中一定含CO32-或SO32-
D.向某溶液中滴加BaCl2溶液,产生不溶于稀硝酸的白色沉淀,不能说明该溶液中一定含SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com