
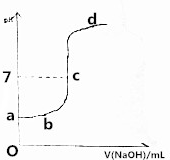
 在研究弱电解质的电离、盐类的水解和溶液中离子浓度大小比较中,某师生共同做了这样一个实验:常温下,向20.0mL,0.1mol/LCH3COOH溶液中逐滴加入0.01mol/L的NaOH溶液,并在滴加过程中不断用pH计测量混合溶液的pH,绘出pH-V(NaOH)图象,如图所示.请分析:
在研究弱电解质的电离、盐类的水解和溶液中离子浓度大小比较中,某师生共同做了这样一个实验:常温下,向20.0mL,0.1mol/LCH3COOH溶液中逐滴加入0.01mol/L的NaOH溶液,并在滴加过程中不断用pH计测量混合溶液的pH,绘出pH-V(NaOH)图象,如图所示.请分析:分析 (1)溶质为CH3COONa时溶液呈碱性,结合图象曲线判断a、b、c、d各点的溶质;
(2)CH3COOH与NaOH恰好完全反应时溶质为醋酸钠,溶液呈碱性;强碱弱酸盐的溶液显示碱性;根据醋酸的物质的量、氢氧化钠溶液浓度计算;
(3)二者恰好反应时溶液呈碱性,酚酞的变色范围为8-10,应该用酚酞为指示剂;
(4)酸溶液或碱溶液抑制了水的电离,能够水解的盐溶液促进了水的电离,据此进行判断;
(5)常温下pH为7时氢离子浓度为:c(H+)=c(OH-)=1×10-7mol/L,根据电荷守恒可知:c(CH3COO-)=c(H+)=$\frac{0.01mol/L×V×1{0}^{-3}L}{(20+V)×1{0}^{-3}L}$=$\frac{0.01V}{20+V}$mol/L,根据物料守恒可知醋酸的浓度为,然后结合醋酸的电离平衡常数表达式计算.
解答 解:(1)常温下,向20.0mL,0.1mol/LCH3COOH溶液中逐滴加入0.01mol/L的NaOH溶液,a点没有滴入NaOH溶液,其溶质为CH3COOH;b点呈酸性,则溶质为CH3COOH、CH3COONa;c点溶液的pH=7,溶质为CH3COOH和CH3COONa;d点溶液呈碱性,溶质可能为CH3COOH和CH3COONa或CH3COONa或CH3COONa和NaOH,
故答案为:CH3COOH、CH3COOH和CH3COONa、CH3COOH和CH3COONa、CH3COOH和CH3COONa或CH3COONa或CH3COONa和NaOH;
(2)CH3COOH与NaOH恰好完全反应生成CH3COONa,醋酸根离子部分水解,溶液显示碱性,所以此时溶液的pHpH>7;根据盐的水解原理可知强碱弱酸盐溶液显示碱性,由此实验可验证CH3COOH为弱酸;20.0mL,0.1mol/LCH3COOH溶液中含有醋酸的物质的量为:0.1mol/L×0.02L=0.002mol,则需要0.002molNaOH才能恰好反应,则需要0.01mol/L的氢氧化钠溶液的体积为:$\frac{0.002mol}{0.01mol/L}$=0.2L=200mL,
故答案为:pH>7;弱;200;
(3)氢氧化钠和醋酸恰好反应时生成醋酸钠,此时溶液呈碱性,酚酞的变色范围为8-10,可以选用酚酞做指示剂,
故答案为:酚酞;
(4)酸溶液中的氢离子,碱溶液中的氢氧根离子都抑制了水的电离,而能够水解的盐溶液会促进水的电离,则溶质为CH3COONa时水的电离程度最大,
故答案为:CH3COONa;
(5)当测得pH为7时共用去V(NaOH)=VmL,此时溶液中氢离子浓度为:c(H+)=c(OH-)=1×10-7mol/L,根据电荷守恒可知:c(CH3COO-)=c(H+)=$\frac{0.01mol/L×V×1{0}^{-3}L}{(20+V)×1{0}^{-3}L}$=$\frac{0.01V}{20+V}$mol/L,根据物料守恒可知醋酸的浓度为:0.1mol/l×$\frac{20mL}{20mL+VmL}$-$\frac{0.01V}{20+V}$mol/L=$\frac{2}{20+V}$mol/L-$\frac{0.01V}{20+V}$mol/L,
则醋酸的电离平衡常数K=$\frac{1×1{0}^{-7}×\frac{0.01V}{20+V}}{\frac{2}{20+V}-\frac{0.01V}{20+V}}$=$\frac{V}{200-V}$×10-7,
答:此时CH3COOH的电离平衡常数K=$\frac{V}{200-V}$×10-7.
点评 本题考查了酸碱混合的定性判断及溶液pH的计算,题目难度中等,明确溶液酸碱性与溶液pH的关系为解答关键,注意掌握电离平衡常数的概念及计算方法,试题培养了学生的分析能力及化学计算能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 反应是放热还是吸热要由反应物和生成物所具有的总能量来决定 | |
| B. | 放热的反应在常温下一定很容易发生 | |
| C. | 若用50mL 0.55mo1•L-1的氢氧化钠溶液,分别与50mL 0.50mo1•L-1的盐酸和 50mL 0.50mo1•L-1的硫酸充分反应,两反应测定的中和热是相等的 | |
| D. | 在101KPa时,1mol碳完全燃烧生成二氧化碳气体时放出的热量为碳的燃烧热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3 mol•L-1氯酸钠溶液 | B. | 3 mol•L-1氯化钙溶液 | ||
| C. | 3 mol•L-1氯化钾溶液 | D. | 3 mol•L-1氯化镁溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碘是人体必需微量元素,所以要多吃富含高碘酸的食物 | |
| B. | 易燃试剂与强氧化性试剂分开放置并远离火源 | |
| C. | 浓H2SO4溅到皮肤上,立即用碳酸钠稀溶液洗涤 | |
| D. | 氢氧化钠浓溶液溅入眼中,应立即用大量水冲洗,再用稀盐酸冲洗 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②③ | C. | ①④ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KCN 与KOCN中氮元素的化合价均为-3价 | |
| B. | 氰酸盐被氧化过程中氮和碳的化合价均升高 | |
| C. | 氰酸盐进一步被氧化的产物之一是无毒的N2 | |
| D. | 完全处理含0.1 mol CN-的废水,理论上需要消耗Cl2的体积为5.6L(标准状况下) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com