
己二酸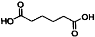 是一种工业上具有重要意义的有机二元酸,在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,能够发生成盐反应、酷化反应等,并能与二元醇缩聚成高分子聚合物等,己二酸产量居所有二元羧酸中的第二位。实验室合成己二酸的反应原理和实验装置示意图如下:
是一种工业上具有重要意义的有机二元酸,在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,能够发生成盐反应、酷化反应等,并能与二元醇缩聚成高分子聚合物等,己二酸产量居所有二元羧酸中的第二位。实验室合成己二酸的反应原理和实验装置示意图如下: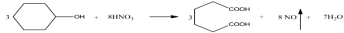
可能用到的有关数据如下:

实验步骤如下:
Ⅰ、在三口烧瓶中加入16mL 50%的硝酸(密度为1.31g/cm),再加入1~2粒沸石,滴液漏斗中盛放有5.4mL环己醇。
Ⅱ、水浴加热三口烧瓶至50℃左右,移去水浴,缓慢滴加5~6滴环己醇,摇动三口烧瓶,观察到有红棕色气体放出时再慢慢滴加剩下的环己醇,维持反应温度在60℃~65 ℃之间。
Ⅲ、当环己醇全部加入后,将混合物用80℃-90℃水浴加热约10min(注意控制温度),直至无红棕色气体生成为止。
Ⅳ、趁热将反应液倒入烧杯中,放入冰水浴中冷却,析出晶体后过滤、洗涤得粗产品。
Ⅴ、粗产品经提纯后称重为5.7g。
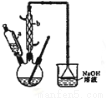
请回答下列问题:
(1)滴液漏斗的细支管a的作用是________,仪器b的名称为________。
(2)己知用NaOH溶液吸收尾气时发生的相关反应方程式为:2NO2+2NaOH=NaNO2 +NaNO3 +H2O
NO+NO2+2NaOH =2NaNO2+H2O;如果改用纯碱溶液吸收尾气时也能发生类似反应,则相关反应方程式为:_________________、__________________;
(3)向三口烧瓶中滴加环己醇时,要控制好环己醇的滴入速率,防止反应过于剧烈导致温度迅速上升,否则可能造成较严重的后果,试列举一条可能产生的后果:_________________________ ________。
________。
(4)为了除去可能的杂质和减少产品损失,可分别用冰水和________洗涤晶体。
(5)粗产品可用________法提纯(填实验操作名称)。本实验所得到的己二酸产率为________。
科目:高中化学 来源:2015-2016学年浙江省宁波市高一下学期选考期中化学试卷(解析版) 题型:选择题
下列各项中表达正确的是
A、NH3分子的电子式: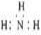 B、CH4分子的比例模型:
B、CH4分子的比例模型: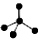
C、氧原子的结构示意图: D、N2的结构式: N≡N
D、N2的结构式: N≡N
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省宁波市高二下学期期中考试化学试卷(解析版) 题型:选择题
某化合物由两种单质直接反应生成,将其加入Ba(HCO3)2溶液中同时有气体和沉淀产生。下列化合物中符合上述条件的是
A.AlCl3 B.Na2O C.FeCl2 D.SiO2
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高一下学期期中考试化学试卷(解析版) 题型:选择题
恒温恒容时,将NO2与SO2以体积比1:2置于密闭容器中发生反应:NO2(g)+SO2(g) SO3(g)+NO(g)下列能说明反应达到平衡状态的是( )
SO3(g)+NO(g)下列能说明反应达到平衡状态的是( )
A.体系压强保持不变
B.混合气体颜色保持不变
C.SO3和NO的体积比保持不变
D.每消耗1 mol SO3的同时生成1 molNO2
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高一下学期期中考试化学试卷(解析版) 题型:选择题
下列关于反应能量的说法正确的是( )
A.Zn(s)+CuSO4(aq)=ZnSO4(aq)+Cu(s) ΔH=-216 kJ·mol-1 ,则反应物总能量大于生成物总能量
B.若一定条件下,A=B ΔH<0,说明A物质比B物质稳定
C.101 kPa时,2H2(g)+O2(g)=2H2O(l)ΔH=-571.6 kJ·mol-1 ,则H2的燃烧热为571.6 kJ·mol-1
D.H+ (aq)+OH- (aq)=H2O(l) ΔH=-57.3 kJ·mol-1 ,含1 mol NaOH的溶液与含0.5 mol H2SO4的浓硫酸混合后放出57.3 kJ的热量.
查看答案和解析>>
科目:高中化学 来源:2016届重庆市高三三诊理综化学试卷(解析版) 题型:选择题
关于下列各实验装置图的叙述中,正确的是
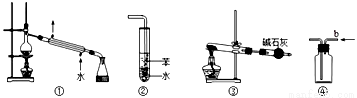
A.装置①可用于分离苯和溴苯的混合物
B.装置②可用于吸收 HCl或 NH3气体
C.装置③可用于分解 NH4Cl制备NH3
D.装置④b口进气可收集CO2或NO气体
查看答案和解析>>
科目:高中化学 来源:2016届云南省高三下第七次月考理综化学试卷(解析版) 题型:填空题
高纯六水氯化锶晶体(SrCl2•6H2O)具有很高的经济价值,工业上用w kg难溶于水的的碳酸锶(SrCO3)为原料(含少量钡和铁的化合物等),共制备高纯六水氯化锶晶体(a kg)的过程为:
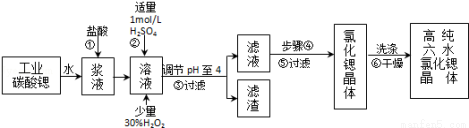
已知:Ⅰ.SrCl2•6H2O晶体在61℃时开始失去结晶水,100℃时失去全部结晶水.
Ⅱ.有关氢氧化物开始沉淀和完全沉淀的pH表:

(1)操作①加快反应速率的措施有________________ (写一种)。操作①中盐酸能否改用硫酸,其理由是:
(2)酸性条件下,加入30% H2O2溶液,将Fe2+氧化成Fe3+,其离子方程式为________.
(3)在步骤②﹣③的过程中,将溶液的pH值由1调节至4时,宜用的试剂为________.
A.氨水 B.氢氧化锶粉末 C. 氢氧化钠 D.碳酸钠晶体
(4)操作③中所得滤渣的主要成分是________ (填化学式).
(5)工业上完成操作③常用的设备有:
A分馏塔 B 离心机 C 热交换器 D 反应釜
(6)工业上用热风吹干六水氯化锶,适宜的温度是____________
A.40~50℃ B.50~60℃ C.60~70℃ D.80℃以上.
(7)已知工业流程中锶的利用率为90%根据以上数据计算工业碳酸锶的纯度:
查看答案和解析>>
科目:高中化学 来源:2016届辽宁师大附中高三下学期精品考试理综化学试卷(解析版) 题型:选择题
现有X、Y、Z、M四种短周期元素,X、Y位于同主族,Z、M位于同主族,Y、Z位于同周期,X与Z、M都不在同一周期,Z的核电荷数是M的2倍。下列说法不正确的是
A. 简单阳离子的氧化性:Y>X
B. 气态氢化物的稳定性:Z<M
C. 简单离子半径由大到小的顺序是:Z>M>Y
D. 等浓度的X2Z与Y2Z的溶液中,水的电离程度:X2Z<Y2Z
查看答案和解析>>
科目:高中化学 来源:2016届海南师大附中高三临考模拟化学试卷(解析版) 题型:选择题
下列离子方程式的书写中正确的是( )
A.将少量碳酸钠溶液滴加到盐酸中 CO32- +2H + =H2O+CO2↑
B.向明矾中加入氢氧化钡使硫酸根完全沉淀 Ba2+ +SO42- =BaSO4↓
C.苯酚钠中通入少量CO2 C6H5O - +CO2 +H2O→C6H5OH+HCO3 -
D.向石灰乳中通入过量的SO2 OH - +SO2=HSO3-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com