
| A. | 光纤通信使用的光缆的主要成分是晶体Si,太阳能电池使用的材枓主要是SiO2 | |
| B. | 水玻璃可用作防火剂或防腐剂 | |
| C. | 高锰酸钾溶液、SO2、双氧水都能杀菌消毒,消毒原理相同,都利用了强氧化性 | |
| D. | SO2可用来漂白纸浆、毛、丝、草帽辫、增白食品等 |
分析 A.光纤通信使用的光缆的主要成分是晶体SiO2,太阳能电池使用的材料主要是Si;
B.水玻璃是矿物胶,不燃烧,而将硅酸钠涂在木材表面就阻隔了木材与空气中氧气的直接接触;
C.高锰酸钾和双氧水都具有强氧化性,SO2不能杀菌消毒;
D.二氧化硫有毒,不能漂白食品.
解答 解:A.光纤通信使用的光缆的主要成分是晶体SiO2,是利用光的全反射原理,太阳能电池使用的材料主要是Si,为重要的半导体材料,故A错误;
B.水玻璃是矿物胶,不燃烧,而将硅酸钠涂在木材表面就阻隔了木材与空气中氧气的直接接触,可用作制备木材防火剂或防腐剂的原料,故B正确;
C.高锰酸钾和双氧水都具有强氧化性,能使蛋白质变性而杀菌消毒,SO2不能杀菌消毒,故C错误;
D.二氧化硫具有漂白性,但有毒,所以不能漂白食品,故D错误;
故选B.
点评 本题考查物质的用途,侧重考查学生分析问题、解决问题,明确物质的性质是解本题关键,易错选项是C,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:实验题
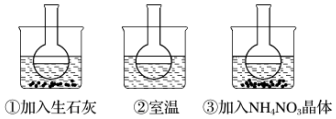
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
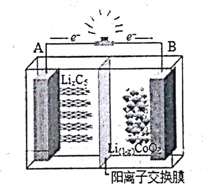 如下图为摇摆电池(Rocking chair battery)的工作原理图,在充放电过程中,Li+在两极之间“摇来摇去”,其总反应为:LiCoO2+6C$?_{放电}^{充电}$Li(1-x)CoO2+LixC6,下列有关说法正确的是( )
如下图为摇摆电池(Rocking chair battery)的工作原理图,在充放电过程中,Li+在两极之间“摇来摇去”,其总反应为:LiCoO2+6C$?_{放电}^{充电}$Li(1-x)CoO2+LixC6,下列有关说法正确的是( )| A. | 放电时,负极反应LiCoO2-xe-═Li(1-x)CoO2+Li+ | |
| B. | 充电时,A极发生氧化反应 | |
| C. | 充电时,Li+穿过隔离膜向B极移动 | |
| D. | 当B极失去xmol电子,电池消1molLiCoO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
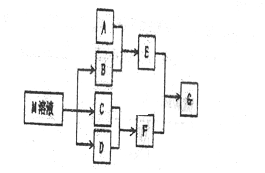
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
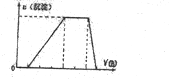
 CO2经催化加氢可合成乙烯:2CO2 (g)+6H2(g)?C2H4(g)+4H2O(g).0.1MPa时,按n(CO2):n(H2)=l:3投料,测得不同温度下平衡时体系中各物质浓度的关系如图.下列叙述不正确的是( )
CO2经催化加氢可合成乙烯:2CO2 (g)+6H2(g)?C2H4(g)+4H2O(g).0.1MPa时,按n(CO2):n(H2)=l:3投料,测得不同温度下平衡时体系中各物质浓度的关系如图.下列叙述不正确的是( )| A. | 该反应的△H<O | |
| B. | 曲线b代表H2O | |
| C. | N点和M点所处状态的c(H2)不一样 | |
| D. | 其它条件不变,T1℃、0.2 MPa下反应达平衡时c(H2)比M点大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2C2O4是氧化剂 | |
| B. | KClO3是还原剂 | |
| C. | H2C2O4在反应中被氧化 | |
| D. | 1molKClO3参加反应有2mol电子转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 地沟油经过加工处理后,可以用来制肥皂和生物柴油 | |
| B. | PM2.5颗粒(微粒直径约为2.5×10-6m)分散在空气中形成气溶胶 | |
| C. | 采用纳米TiO2光触媒技术,可将装修材料中释放的HCHO转化为无害物质 | |
| D. | 神舟十一号飞船所用太阳能电池板可将光能转换为电能,所用转换材料是硅晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀的pH | 1.1 | 6.5 | 7.1 |
| 沉淀完全的pH | 3.2 | 9.7 | 9.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
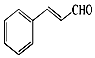 自然界中的许多植物中含有醛,其中有些具有特殊的香味,可作为植物香料使用.桂皮中含有肉桂醛,结构如图,杏仁中含有苯甲醛.以下说法错误的是( )
自然界中的许多植物中含有醛,其中有些具有特殊的香味,可作为植物香料使用.桂皮中含有肉桂醛,结构如图,杏仁中含有苯甲醛.以下说法错误的是( )| A. | 肉桂醛分子中含有两种官能团,分子式为C9H8O | |
| B. | 肉桂醛分子中最多有18个原子共平面 | |
| C. | 1 mol肉桂醛与氢气加成时最多消耗4 mol H2 | |
| D. | 肉桂醛与苯甲醛不是同系物,但都能发生氧化反应和还原反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com