
| 编号 | 叙述I | 叙述II |
| A | Fe3+的氧化性比Cu2+强 | FeCl3溶液可用于溶解回收旧电路板中的铜 |
| B | NH4Cl受热分解 | 加热可将Ca(OH)2和NH4Cl固体混合物分离 |
| C | 金属活动性铜比铁弱 | 镀铜铁制品表层划损后仍然受到保护 |
| D | Cl2具有漂白性 | 用氯气制盐酸 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.Cu与氯化铁反应生成氯化铜、氯化亚铁;
B.氯化铵不稳定,铵盐与碱加热生成氨气;
C.镀铜铁制品表层划损后,构成原电池中Fe为负极;
D.氯气不具有漂白性.
解答 解:A.Cu与氯化铁反应生成氯化铜、氯化亚铁,可知Fe3+的氧化性比Cu2+强,叙述均合理,且存在因果关系,故A正确;
B.氯化铵不稳定,铵盐与碱加热生成氨气,叙述合理,但二者不存在因果关系,故B错误;
C.镀铜铁制品表层划损后,金属活动性铜比铁弱,构成原电池中Fe为负极,加快腐蚀,叙述II不合理,故C错误;
D.氯气不具有漂白性,叙述I不合理,而用氯气制盐酸合理,故D错误;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,涉及氧化还原反应、物质的性质、原电池及应用等,把握物质的性质、反应原理为解答的关键,侧重分析与实验能力的考查,综合性较强,题目难度不大.


 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在三种元素中,元素Z的非金属性最强 | |
| B. | 气态氢化物的还原性按X、Y、Z的顺序逐渐增强 | |
| C. | Y元素一定是硫 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
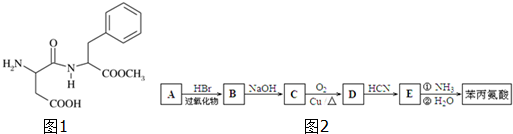
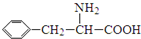 )是合成APM的原料之一.苯丙氨酸的一种合成途径如图2所示:
)是合成APM的原料之一.苯丙氨酸的一种合成途径如图2所示: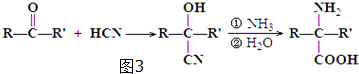
 .
.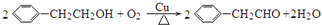 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业电解饱和食盐水:2Cl-+H2O=Cl2↑+H2↑+OH- | |
| B. | 碳酸钠的水解:CO32-+2H2O═H2CO3+2OH- | |
| C. | 硫酸铝溶液中滴加过量浓氨水:Al3++4 NH3•H2O═AlO${\;}_{2}^{-}$+4NH4++2H2O | |
| D. | 用过氧化氢从酸化海带灰浸出液中提取碘:2I-+H2O2+2H+=I2+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
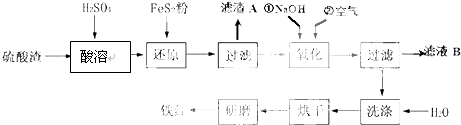
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.8 | 7.6 | 9.4 |
| 完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com