
A、B、C、D四种物质均为下列离子组成的可溶性化合物,组成这四种物质的离子(离子不能重复组合)有:
| 阳离子 | Na+、Al3+、Ba2+、NH4+ |
| 阴离子 | Cl-、OH-、CO32-、SO42- |
(1)Na+> Al3+(1分) Cl-
(2)酸性 Al3++3H2O Al(OH)3+3H+ (NH4)2CO3
Al(OH)3+3H+ (NH4)2CO3
(3)13 2Cl- -2e-=Cl2(1分(4)C(Na+)> C(Cl-)>C(ClO-)>C(OH-)>C(H+)
解析试题分析:
②根据A溶液与D溶液混合并加热有气体生成,该气体能使湿润的红色石蕊试液变蓝,气体为氨气,①B溶液分别与C、D混合,均有白色沉淀生成;③A溶液与D溶液反应生成白色沉淀,再加过量A,沉淀量减少,至完全消失,④用石墨电极电解B溶液,在阳极上产生一种有刺激性气味的气体。则A为NaOH,C为Al2(SO4)2,B为Ba Cl2, D为(NH4)2CO3,
(1)Na+与 Al3+同一周期,核外电子排布相同,核电荷数越大,半径越小,所以Na+> Al3+;B为Ba Cl2,阴离子是氯离子。
(2)C为强酸弱碱盐,溶液呈酸性;其原因是Al3+水解所致,Al3++3H2O Al(OH)3+3H+
Al(OH)3+3H+
D的化学式是(NH4)2CO3
(3)用惰性电极电解BaCl2,时,阳极上是氯离子失电子,电极反应为:2Cl--2e-═Cl2↑,阴极上是氢离子得电子,2H++2e-═H2↑,当电源提供给0.1mol电子时,根据2H++2e-═H2↑可知,生成0.05mol氢气,所以溶液中氢氧根离子n(OH-)=0.1mol,此溶液体积为1L,溶液中c(OH-)="n" v ="0.1mol" /1L =0.1mol/L,c(H+)="Kw" /C(OH?) =10?14 /0.1 mol/L=10-13mol/L,所以pH=13,
(4)将④阳极产生的气体通入A溶液中至恰好完全反应时,即发生Cl2+2NaOH═NaCl+NaClO+H2O,得到的是等物质的量的NaCl、NaClO的混合溶液,NaClO是强碱弱酸盐,ClO-水解,溶液呈碱性,所以有:C(Na+)> C(Cl-)>C(ClO-)>C(OH-)>C(H+)
考点:阴阳离子组合的分析和判断


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
煤是重要的能源,也是生产化工产品的重要原料。试用所学知识,解答下列问题:
(1)煤的转化技术包括煤的气化技术和液化技术。煤的液化技术又分为________和________。
(2)在煤燃烧前需对煤进行脱硫处理。煤的某种脱硫技术的原理为FeS2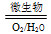 Fe2++SO42—
Fe2++SO42—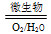 Fe3+这种脱硫技术称为微生物脱硫技术。该技术的第一步反应的离子方程式为_____________________________,
Fe3+这种脱硫技术称为微生物脱硫技术。该技术的第一步反应的离子方程式为_____________________________,
第二步反应的离子方程式为____________________。
(3)工业煤干馏得到的产品有焦炭、________。
(4)工业上主要采用氨氧化法生产硝酸,如图是氨氧化率与氨-空气混合气中氧氨比的关系。其中直线表示反应的理论值;曲线表示生产实际情况。当氨氧化率达到100%,理论上r[n(O2)/n(NH3)]=________,实际生产要将r值维持在1.7~2.2之间,原因是__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某工业废水仅含下表中的某些离子,且各种离子的物质的量浓度相等,均为0.1 mol/L(此数值忽略水的电离及离子的水解)。
| 阳离子 | K+ Ag+ Mg2+ Cu2+ Al3+ NH4+ |
| 阴离子 | Cl- CO32— NO3— SO42— SiO32— I- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(8分)食盐中的抗结剂是亚铁氰化钾,其化学式为K4[Fe(CN)6]·3H2O。42.2 g K4[Fe(CN)6]·3H2O样品受热脱水过程的热重曲线(样品质量随温度的变化曲线)如下图所示。
试回答下列问题:
(1)试确定150 ℃时固体物质的化学式_____________。
(2)查阅资料知:虽然亚铁氰化钾自身毒性很低,但其水溶液与酸反应放出极毒的氰化氢(HCN)气体;亚铁氰化钾加热至一定温度时能分解产生氰化钾(KCN)。据此判断,烹饪食品时应注意的问题为_____________________________________________________。
(3)在Fe2+、Fe3+的催化作用下,可实现2SO2+O2+2H2O=2H2SO4的转化。已知,含SO2的废气通入含Fe2+、Fe3+的溶液中时,其中一个反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O,则另一个反应的离子方程式为__________________________。
(4)已知Fe(OH)3的溶度积常数Ksp=1.1×10-36。室温时在FeCl3溶液中滴加NaOH溶液,当溶液pH为3时,通过计算说明Fe3+是否沉淀完全_____________。(提示:当某离子浓度小于10-5 mol·L-1时可以认为该离子沉淀完全)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
常见的五种盐A、B、C、D、E,它们的阳离子可能是Na+、NH4+、Cu2+、Ba2+、Al3+、Ag+、Fe3+,阴离子可能是Cl-、NO3—、SO42—、CO32—,已知:
①五种盐均溶于水,水溶液均为无色。
②D的焰色反应呈黄色。
③A的溶液呈中性,B、C、E的溶液呈酸性,D的溶液呈碱性。
④若在这五种盐的溶液中分别加入Ba(NO3)2溶液,只有A、C的溶液不产生沉淀。
⑤若在这五种盐的溶液中,分别加入氨水,E和C的溶液中生成沉淀,继续加氨水,C中沉淀消失。
⑥把A的溶液分别加入到B、C、E的溶液中,均能生成不溶于稀硝酸的沉淀。
请回答下列问题。
(1)五种盐中,一定没有的阳离子是____________;所含阴离子相同的两种盐的化学式是________________。
(2)D的化学式为______________,D溶液显碱性的原因是(用离子方程式表示)__________________________________________。
(3)A和C的溶液反应的离子方程式是_________________________;E和氨水反应的离子方程式是____________________。
(4)若要检验B中所含的阳离子,正确的实验方法是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
有下列物质:① 氢氧化钠固体;② 铜丝;③ 氯化氢气体;④ 稀硫酸;⑤ 二氧化碳气体; ⑥氢氧化钾溶液;⑦ 碳酸钠粉末;⑧ 蔗糖晶体;⑨ 熔融氯化钠,请用序号填空:
(1)上述状态下可导电的是________;(2)属于电解质的是________;(3)属于非电解质的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
根据要求回答下列各题
(Ⅰ)现有 ①铝 ②NH3③氢氧化钠溶液 ④液态氯化氢 ⑤AgCl固体⑥冰醋酸 ⑦蔗糖,填空回答(填序号):
以上物质中(1)属于电解质的是 ;(2)属于非电解质的是 ;
(3)属于强电解质的是 ;(4)能导电的是 。
(Ⅱ)写出下列反应的化学方程式:
①有NaHCO3生成的化合反应
② 有MgCl2参加的分解反应
③ 有Fe2O3参加的置换反应
④ 有HNO3生成的复分解反应
(Ⅲ).同温同压条件下,同体积的CH4和SO2的质量之比是 ;同质量的CH4和SO2的体积之比是 ;若两者所含原子个数总数相等,则CH4和SO2的质量之比是 。
(Ⅳ)把铁片和石墨棒用下列a、b两种方式放在盛有稀硫酸钠溶液和酚酞试液混合溶液的玻璃器皿中,经过一段时间后,首先观察到溶液变红的区域是 (填序号)。
| A.Ⅰ和Ⅲ附近 | B.Ⅰ和Ⅳ附近 | C.Ⅱ和Ⅲ附近 | D.Ⅱ和Ⅳ附近 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某种物质溶于水后得到的溶液中,含有Fe2+、Fe3+、SO42-、NH4+、Ba2+、CO32-离子中的某几种。
(1)甲同学欲探究溶液的组成,进行了如下实验:①取少量溶液于试管中,逐滴加入浓氢氧化钠溶液,发现开始生成白色沉淀,白色沉淀迅速变为灰绿色,最后变为红褐色,同时伴有刺激性气体放出;②另取少量溶液于试管中,加入足量盐酸酸化后再滴加氯化钡溶液,有白色沉淀生成。
该溶液中一定含有的离子是 ;
写出①中白色沉淀转化为红褐色沉淀的化学方程式 。
(2)乙同学进行如下实验:取少量溶液于试管中,滴加几滴硫氰酸钾溶液,无明显现象;再滴加H2O2,发现溶液变红色;继续滴加H2O2,红色逐渐褪去且有气泡产生。为弄清其中缘由,乙同学查阅资料知:
H2O2+SCN-→SO42-+CO2↑+N2↑+H2O+H+
①该反应中,被氧化的元素为 ,每生成lmol CO2转移的电子数为 NA;
②根据乙同学的实验现象,请判断还原性强弱为:Fe2+ SCN-(填<、=或>);
③根据资料,乙同学提出的猜想是:H2O2将SCN-氧化使红色逐渐褪去。请你设计一个实验,验证乙同学的猜想是否正确 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
.现有失去标签的四瓶无色溶液A.B.C.D,只知道它们是K2CO3.K2SO4.H2SO4和Ba(NO3)2,为了鉴别它们,进行如下实验:
①A+D―→溶液+气体 ②B+C―→溶液+沉淀
③B+D―→溶液+沉淀 ④A+B―→溶液+沉淀
将④得到的沉淀物加入③所得溶液中,④中沉淀很快溶解并产生无色无味的气味。
(1)根据以上实验事实,A.C.D三种无色溶液分别为________、________、________(用化学式表示)。
(2)写出①②中发生反应的离子方程式:
① ;
② 。
(3)离子反应是中学化学中重要的反应类型,在发生离子反应的反应物或生成物中,一定存在有
①单质 ②氧化物 ③电解质 ④盐 ⑤化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com