
| 实验编号 | HA物质的量浓度(mol•L-1) | NaOH物质的量浓度(mol•L-1) | 混合溶液的pH |
| 甲 | 0.2 | 0.2 | pH=a |
| 乙 | c | 0.2 | pH=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=9 |
分析 (1)酸碱的物质的量相等,如为强酸,反应后溶液呈中性,如为弱酸,反应后溶液呈酸性;
(2)从溶液电中性的角度分析;
(3)等物质的量的酸碱反应后溶液呈碱性,由于NaOH为强碱,则该酸为弱酸.
(4)等物质的量的酸碱反应后溶液呈碱性,溶液中氢氧根离子全部来自于弱酸根离子水解得到的,水电离出的氢离子等于水电离出的氢氧根离子,根据电荷守恒计算;溶液中存在质子守恒,根据质子守恒得c(OH-)-c(HA)=c(H+).
解答 解:(1)一元酸HA和NaOH溶液等体积混合,两种溶液的物质的量浓度都为0.2mol/L,则酸碱的物质的量相等,如a=7,说明反应后溶液呈中性,则HA是强酸,如a>7,反应后呈碱性,则HA是弱酸,
故答案为:a=7,HA是强酸;a>7,HA是弱酸;
(2)由于反应后溶液呈中性,则有c(OH-)=c(H+),根据溶液呈中性,则有c(Na+)+c(H+)=c(A-)+c(OH-),所以c(A-)=c(Na+),
故答案为:c(A-)=c(Na+);
(3)等物质的量的酸碱反应后溶液呈碱性,由于NaOH为强碱,则该酸为弱酸,在溶液中存在A-+H2O?HA+OH-,则c(Na+)>c(A-),溶液呈碱性,则c(OH-)>c(H+),一般来说,盐类的水解程度较低,则有c(A-)>c(OH-),所以有:c(Na+)>c(A-)>c(OH-)>c(H+),
故答案为:弱;c(Na+)>c(A-)>c(OH-)>c(H+);
(4)溶液的pH=9,则氢离子浓度为10-9 mol/L,等物质的量的酸碱反应后溶液呈碱性,溶液中氢氧根离子全部来自于弱酸根离子水解得到的,c(OH-)=$\frac{{K}_{w}}{c({H}^{+})}$=$\frac{1{0}^{-14}}{1{0}^{-9}}$mol/L=10-5 mol/L,
水电离出的氢离子浓度等于溶液中氢氧根离子浓度为10-5 mol/L,根据电荷守恒得:c (Na+)+c (H+)=c (A-)+c (OH-),所以c (Na+)-c (A-)=c (OH-)-c (H+)=[10-5-10-9]mol/L,溶液中存在质子守恒,根据质子守恒得c(OH-)-c(HA)=c(H+)=10-9mol/L
故答案为:10-5;10-5-10-9;10-9.
点评 本题考查酸碱混合的判断,题目难度中等,本题注意分析表中数据,从弱电解质的电离和盐类水解的角度解答,学习中注重相关规律和方法的积累.


科目:高中化学 来源: 题型:选择题
| A. | CH3OH的燃烧热(△H)为-192.9kJ•mol-1 | |
| B. | 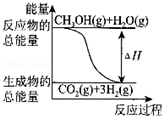 反应①中的能量变化如图所示 | |
| C. | CH3OH转变成H2的过程一定要吸收能量 | |
| D. | 根据②推知反应:CH3OH(l)+O2(g)═CO2(g)+2H2(g)的△H>-192.9kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气溶于水中:Cl2+H2O=2H++Cl-+ClO- | |
| B. | 硫酸氢钠溶液与氢氧化钡溶液混合至混合液呈中性:2HSO4-+Ba2++2OH-=BaSO4↓+2H2O+SO42- | |
| C. | 向双氧水中加入稀硫酸和KI溶液:H2O2+2H++2I-=I2+2H2O | |
| D. | 用铜作阳极电解CuSO4溶液:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸钠的水解反应:CH3COO-+H2O═CH3COOH+OH- | |
| B. | 碳酸氢钙与过量的NaOH溶液反应Ca2++2HCO3-+2OH-═CaCO3↓+2H2O+CO32- | |
| C. | 苯酚钠溶液与过量二氧化碳反应:C6H5O-+CO2+H2O═C6H5OH+CO32- | |
| D. | 稀硝酸与过量的铁屑反应:3Fe+8H++2NO3-═3 Fe3++2NO↑+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 给试管中的液体加热时,试管口不准对着别人,但可以对着自己 | |
| B. | 玻璃仪器都可以用于加热 | |
| C. | 在H2还原氧化铜的实验中,应把H2通过预先加热的氧化铜 | |
| D. | 无论给试管中的液体还是固体加热,都必须先预热 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com