
 向20mL 0.1mol•L-1的CH3COOH溶液逐滴加入0.1mol•L-1NaOH溶液,pH变化曲线如图所示,下列说法错误的( )
向20mL 0.1mol•L-1的CH3COOH溶液逐滴加入0.1mol•L-1NaOH溶液,pH变化曲线如图所示,下列说法错误的( )| A. | 在a点,溶液pH>1 | |
| B. | 在b点,CH3COOH的Ka≈c(H+) | |
| C. | 在c点,c(CH3COO-)=c(Na+)=0.1 mol•L-1 | |
| D. | 在d点,c(CH3COO-)+c(CH3COOH)=c(Na+) |
分析 A.a点没有滴入氢氧化钠溶液,醋酸为弱酸,0.1mol/L的醋酸溶液中氢离子浓度小于0.1mol/L;
B.b点时反应后溶质为等浓度的醋酸和醋酸钠,醋酸根离子与醋酸的浓度几乎相等,结合醋酸的电离平衡常数表达式计算;
C.c点时溶液的pH=7,则c(H+)=c(OH-),根据电荷守恒可知:c(CH3COO-)=c(Na+),由于溶液体积增大,则二者的浓度都小于0.1mol/L;
D.d点时溶质为醋酸钠,根据物料守恒判断.
解答 解:A.a点为0.1mol/L的醋酸溶液,醋酸为弱电解质,溶液中部分电离出氢离子,则氢离子浓度小于0.1mol/L,溶液的pH大于1,故A正确;
B.b点加入10mL氢氧化钠溶液,反应后溶质为等浓度的醋酸和醋酸钠,溶液中c(CH3COO-)≈c(CH3COOH),则醋酸的电离平衡常数K=$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$≈c(H+),故B正确;
C.c点时溶液的pH=7,则c(H+)=c(OH-),根据电荷守恒可知:c(CH3COO-)=c(Na+),由于溶液体积增大,则c(CH3COO-)=c(Na+)<0.1mol/L,故C错误;
D.在d点,加入20mL氢氧化钠溶液,二者恰好反应生成醋酸钠,根据物料守恒可得:c(CH3COO-)+c(CH3COOH)=c(Na+),故D正确;
故选C.
点评 本题考查了酸碱混合的定性判断及溶液pH的计算、离子浓度大小比较,题目难度中等,注意掌握酸碱混合的定性判断方法,明确物料守恒、电荷守恒在判断离子浓度大小中的应用方法.


科目:高中化学 来源: 题型:选择题
| A. | 纤维素在人体内可水解为葡萄糖,故可作人类的营养物质 | |
| B. | 鱼虾会产生不愉快的腥臭味,可在烹调时加入少量食醋和料酒 | |
| C. | 被蜂蚁蜇咬会感觉疼痛难忍,这是由于人的皮肤被注入了甲酸的缘故,此时若能涂抹稀氨水或碳酸氢钠溶液,可以减轻疼痛 | |
| D. | 苯酚溶液可用于环境消毒,医用酒精可用于皮肤消毒,其原因均在于可使蛋白质变性凝固 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ③⑥ | C. | ②④ | D. | ③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. |  向1L浓度均为0.1mol/L的Ba(OH)2、NaAlO2混合液加入0.1 mol/L稀H2SO4溶液 向1L浓度均为0.1mol/L的Ba(OH)2、NaAlO2混合液加入0.1 mol/L稀H2SO4溶液 | |
| B. |  向含有0.1 mol/L AlCl3和0.3mol/L NH4Cl的混合液1L中加入0.1mol/L NaOH溶液 向含有0.1 mol/L AlCl3和0.3mol/L NH4Cl的混合液1L中加入0.1mol/L NaOH溶液 | |
| C. |  向氢氧化钠溶液滴加明矾[KAl(SO4)2]溶液,[已知AlO2-和Al3+在溶液中生成Al(OH)3] 向氢氧化钠溶液滴加明矾[KAl(SO4)2]溶液,[已知AlO2-和Al3+在溶液中生成Al(OH)3] | |
| D. |  向AlCl3溶液滴加过量氨水 向AlCl3溶液滴加过量氨水 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
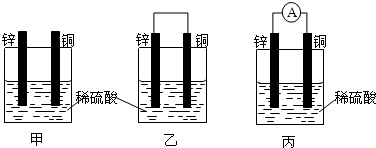
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Fe(NO3)2稀溶液中加入稀盐酸:Fe2++2H++NO3-═Fe3++NO2↑+H2O | |
| B. | 向NaHSO4溶液中加入过量的Ba(OH)2溶液:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O | |
| C. | 向(NH4)2Mg(SO4)2溶液中加入少量的Na2O:Mg2++Na2O+H2O═Mg(OH)2↓+2Na+ | |
| D. | 向0.1mol•L-1、pH=1的NaHA溶液中加入NaOH溶液:HA-+OH-═A2-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=13的溶液:K+、Na+、Cl-、SiO32- | |
| B. | c(H+)/c(OH-)=1×10-14的溶液:Na+、NH4+、Cl-、SO42- | |
| C. | 0.1mol•L-1的Na2CO3溶液:Na+、Ca2+、I-、SO42- | |
| D. | 加入石蕊呈蓝色的溶液:Na+、Al3+、Cl-、NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com