
| 选项 | 实验方法 | 现象 | 结论 |
| 向某溶液加入AgNO3溶液 | 出现白色沉淀 | 原溶液中一定有Cl- | |
| 向某溶液加入BaCl2溶液 | 出现白色沉淀 | 原溶液中一定有SO42- | |
| 向某溶液加入NaOH溶液 | 出现蓝色沉淀 | 原溶液中一定有Cu2+ | |
| 向某溶液加入H2SO4溶液 | 产生无色无味气体 | 原溶液中一定有CO32- |
| A. | A | B. | B | C. | C | D. | D |
分析 A.检验氯离子,应排出硫酸根、碳酸根等离子的影响;
B.可能生成AgCl沉淀;
C.氢氧化铜为蓝色沉淀;
D.可能为HCO3-等.
解答 解:A.加入AgNO3溶液,可能生成硫酸银、碳酸银等沉淀,应先加入硝酸酸化,故A错误;
B.白色沉淀可能为AgCl,且硝酸酸化可能将亚硫酸根离子氧化为硫酸根离子,应先加盐酸,再加BaCl2溶液检验SO42-,故B错误;
C.氢氧化铜为蓝色沉淀,则加入氢氧化钠生成蓝色沉淀,一定含有铜离子,故C正确;
D.HCO3-也可与酸反应生成二氧化碳气体,不一定含有碳酸根离子,故D错误.
故选C.
点评 本题考查物质的检验和鉴别实验方案的设计,为高频考点,把握离子的检验方法、试剂及现象与结论为解答的关键,侧重离子检验的考查,注意检验应排除干扰离子,题目难度不大.


 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案科目:高中化学 来源: 题型:选择题
| A. | Na与水反应:Na+2H2O═Na++2OH-+H2↑ | |
| B. | 0.01mol/L NH4Al(SO4)2溶液与0.02mol/L Ba(OH)2溶液等体积混合 NH4++Al3++2SO42-+2Ba2++4 OH-═2 Ba SO4↓+Al(OH)3↓+NH3•H2O | |
| C. | 硅酸钠溶液与醋酸溶液混合:SiO32-+2H+═H2SiO3↓ | |
| D. | 浓硝酸中加入过量铁粉并加热:Fe+3NO3-+6H+ $\frac{\underline{\;\;△\;\;}}{\;}$Fe3++3NO2↑+3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E、F六种物质在一定条件下有如图所示的相互转化关系,所有反应物和生成物均已给出.
A、B、C、D、E、F六种物质在一定条件下有如图所示的相互转化关系,所有反应物和生成物均已给出.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
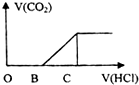 向某NaOH溶液中通入CO2气体后 得到溶液M,因CO2通入的量不同,溶液M的组成也不同,若向M中逐滴加入盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系如图所示.则下列分析与判断正确的是(不计CO2溶解)( )
向某NaOH溶液中通入CO2气体后 得到溶液M,因CO2通入的量不同,溶液M的组成也不同,若向M中逐滴加入盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系如图所示.则下列分析与判断正确的是(不计CO2溶解)( )| A. | 若OB=0,则溶液M为Na2CO3溶液 | |
| B. | 若OB=BC,则形成溶液M所发生反应的离子方程式为OH-+CO2═HCO3- | |
| C. | 若3OB=BC,则溶液M中c(NaHCO3)=2c(Na2CO3) | |
| D. | 若OB>BC,则溶液M中大量存在的阴离子为CO32-和HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA | |
| B. | 标准状况下,1.12L16O2和1.12L18O2均含有0.1NA个氧原子 | |
| C. | 0.1 mol铁在0.1 mol Cl2中充分燃烧,转移的电子数为0.3 NA | |
| D. | 常温下,1L 0.1 mol•L-1的Na2CO3溶液中含有的离子总数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
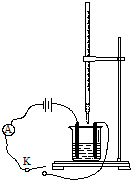 如图,向碱式滴定管和烧杯中分别注入0.2mol•L-1Ba(OH)2溶液和0.1mol•L-1稀硫酸各50mL,并向稀硫酸中滴加几滴石蕊溶液,按如图装置连接好.
如图,向碱式滴定管和烧杯中分别注入0.2mol•L-1Ba(OH)2溶液和0.1mol•L-1稀硫酸各50mL,并向稀硫酸中滴加几滴石蕊溶液,按如图装置连接好.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 )和双氧水为原料生产过氧化苯甲酰,写出合成过氧化苯甲酰的化学反应方程式:
)和双氧水为原料生产过氧化苯甲酰,写出合成过氧化苯甲酰的化学反应方程式: ;
;
 ,属于酚类结构的同分异构体有3种.
,属于酚类结构的同分异构体有3种.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com