
| A、1:2 | B、3:8 |
| C、5:6 | D、4:7 |


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
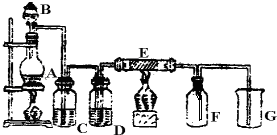 (Ⅰ)在下面的装置中,A是Cl2发生装置,C、D为气体的净化装置,E是硬质玻璃管中装有细铁丝网;F为干燥的广口瓶,烧杯G为尾气吸收装置.
(Ⅰ)在下面的装置中,A是Cl2发生装置,C、D为气体的净化装置,E是硬质玻璃管中装有细铁丝网;F为干燥的广口瓶,烧杯G为尾气吸收装置.查看答案和解析>>
科目:高中化学 来源: 题型:
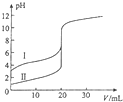 室温下,用0.100mol/L NaOH溶液分别滴定20.00ml 0.100mol/L 的盐酸和醋酸,滴定曲线如图所示,下列说法正确的是( )
室温下,用0.100mol/L NaOH溶液分别滴定20.00ml 0.100mol/L 的盐酸和醋酸,滴定曲线如图所示,下列说法正确的是( )| A、Ⅱ表示的是滴定醋酸的曲线 |
| B、PH=7时,滴定醋酸消耗V(NaOH)小于20ml |
| C、V(NaOH)=20ml时,C(Cl-)=C(CH3COO-) |
| D、V(NaOH)=10ml时,醋酸溶液中:C(Na+)>C(CH3COO- )>C(H+)>C(OH- ) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原电池是将化学能转化为电能的装置 |
| B、电镀过程相当于金属的“迁移”,可认为是物理变化 |
| C、不能自发进行的氧化还原反应通过电解的方法有可能实现 |
| D、从理论上说,任何一个可自发进行的氧化还原反应都可以设计成原电池反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲>乙>丙 |
| B、乙>甲>丙 |
| C、乙>丙>甲 |
| D、丙>乙>甲 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HCO3-+H2O?H3O++CO32- |
| B、Fe3++3H2O?Fe(OH)3+3H+ |
| C、HS-+H2O?H2S+OH- |
| D、HCOOH+H2O?HCOO-+H3O+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com