
| A. | 工业上可用更为廉价的Cl2来代替ClO2 | |
| B. | 利用该原理处理含Mn2+的污水后溶液的pH升高 | |
| C. | 该反应中氧化产物和还原产物的物质的量之比为2:5 | |
| D. | 理论上处理含1mol Mn2+的污水,需要标准状况下的ClO28.96L |
分析 二氧化氯(ClO2)对酸性污水中的Mn2+也有明显的去除效果,其反应原理为:ClO2+Mn2+→MnO2↓+Cl-,根据得失电子守恒和电荷守恒补全反应方程式为:
2ClO2+5Mn2++6H2O=5MnO2↓+2Cl-+12H+,其中ClO2为氧化剂,生成2Cl- 为还原产物,Mn2+为还原剂,生成MnO2为氧化产物,据此分析解答.
解答 解:A.因为氯气有毒并且氧化效果没有ClO2好,故A错误;
B.由2ClO2+5Mn2++6H2O=5MnO2↓+2Cl-+12H+,所以处理含Mn2+的污水后溶液的pH降低,故B错误;
C.由2ClO2+5Mn2++6H2O=5MnO2↓+2Cl-+12H+,其中ClO2为氧化剂,生成2Cl- 为还原产物,Mn2+为还原剂,生成5MnO2为氧化产物,所以该反应中氧化产物和还原产物的物质的量之比为5:2,故C错误;
D.由2ClO2+5Mn2++6H2O=5MnO2↓+2Cl-+12H+,则理论上处理含1mol Mn2+的污水,需要标准状况下的ClO2为$\frac{2}{5}$×22.4=8.96L,故D正确.
故选D.
点评 本题考查氧化还原反应,明确反应中的基本概念,并学会利用元素的化合价变化来分析补全氧化还原反应方程式以及氧化剂、还原剂等,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 形成较多的白色沉淀 | |
| B. | 形成的沉淀纯度更高 | |
| C. | 排除Ba2+以外的其它阳离子的干扰 | |
| D. | 排除SO42-以外的其它阴离子及Ag+的干扰 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠着火,用水或CO2灭火器灭火 | |
| B. | 少量白磷保存在煤油中 | |
| C. | 不小心把水银洒落在地面,盖沙处理 | |
| D. | 硝酸银保存在棕色试剂瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、Y、Z形成的化合物不止一种 | |
| B. | X的氢化物比Y的氢化物稳定 | |
| C. | 原子半径的大小顺序:r(W)>r(Z)>r(Y)>r(X) | |
| D. | Y与Z或W形成的化合物中只含离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8.4gNaHCO3晶体中含有0.1NA个CO32- | |
| B. | 常温常压下,32g臭氧所含的氧原子数为2NA | |
| C. | 0.1molFe与过量硝酸反应,转移电子数为0.2NA | |
| D. | 1molCH4与1molCl2在光照下反应,生成CH3Cl的分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
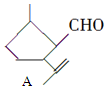 ,下列检验A中官能团的试剂和顺序正确的是( )
,下列检验A中官能团的试剂和顺序正确的是( )| A. | 先加溴水,再加KMnO4酸性溶液 | |
| B. | 先加入足量的新制Cu(OH)2悬浊液,微热,酸化后再加溴水 | |
| C. | 先加银氨溶液,微热,再加溴水 | |
| D. | 先加KMnO4酸性溶液,再加银氨溶液,微热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 | 0.600 | 0.500 | 0.400 | a |
| 318.2 | 3.60 | c | 2.40 | 1.80 |
| 328.2 | 9.00 | 7.50 | d | 4.50 |
| b | 2.16 | 1.80 | 1.44 | 1.08 |
| A. | a<0.400 | B. | c>2.40 | C. | b<318.2 | D. | d<1.44 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com