
| A. | 容器I、II中正反应速率相同 | |
| B. | 容器I中CO 的物质的量比容器II中的多 | |
| C. | 容器I、III中反应的平衡常数相同 | |
| D. | 容器I中CO 的转化率与容器II中CO2 的转化率之和等于1 |
分析 A.由于该反应正向是放热反应,且三个容器均恒容绝热,因此容器Ⅰ、Ⅱ随着反应的进行温度变得不一样,平衡时各物质的浓度也不一样,正反应速率也不一样;
B.容器Ⅱ中所到达的平衡状态,相当于在容器Ⅰ中的基础上降低温度,平衡向正反应移动,所以容器Ⅰ中A 的物质的量比容器Ⅱ中的多;
C.K只与温度有关,Ⅰ、Ⅲ两个容器恒容绝热,反应物的量不同反应的热效应不同,体系温度不同,K不同;
D.容器Ⅰ中A 的转化率与容器Ⅱ中C的转化率之和小于1.
解答 解:A.由于该反应正向是放热反应,且三个容器均恒容绝热,因此容器Ⅰ、Ⅱ随着反应的进行温度变得不一样,平衡时各物质的浓度也不一样,正反应速率也不一样,故A错误;
B.如果容器容器Ⅰ、Ⅱ均在恒温恒容条件下反应,那么Ⅰ、Ⅱ是等效平衡,达到平衡A的物质的量相等,而现在在恒容绝热条件下反应,正向放热,Ⅱ中所到达的平衡状态,相当于在容器Ⅰ中的基础上降低温度,平衡向正反应移动,所以容器Ⅰ中A 的物质的量比容器Ⅱ中的多Ⅰ中A 的物质的量和容器Ⅱ中的多,故B正确;
C.K只与温度有关,Ⅰ、Ⅲ两个容器恒容绝热,反应物的量不同反应的热效应不同所以K不同,故C错误;
D.如果温度相同时,容器Ⅰ中A的转化率与容器Ⅱ中C的转化率之和等于1,因为容器绝热,容器Ⅱ中所到达的平衡状态,相当于在容器Ⅰ中的基础上降低温度,平衡向正反应移动,C的转化率比两容器相同温度时容器Ⅱ中C的转化率低,所以容器Ⅰ中A 的转化率与容器Ⅱ中C的转化率之和小于1,故D错误.
故选B.
点评 本题考查了化学平衡建立的过程分析,平衡影响因素分析判断,注意不要忽略容器绝热,反应的热效应,题目难度中等.


 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:多选题

| A. | 如图甲在T2线上,正反应速率:N点>W点 | |
| B. | 如图甲在T2下,在0~t1时间内的平均速率,v(X)=$\frac{a-b}{{t}_{1}}$ mol•L-1•min-1 | |
| C. | 增加C的量,化学反应速率增大 | |
| D. | 如图乙,t0时可能是加入了催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④⑤⑥ | B. | ①③⑤ | C. | ②④⑥ | D. | ③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氟酸不能存放于玻璃瓶中 | |
| B. | 氯水存放于棕色试剂瓶中 | |
| C. | 少量金属钠保存在煤油中 | |
| D. | 氢氧化钠溶液存放于玻璃塞的试剂瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知反应:A(s)+3B(g)?2C(g)△H<0,在体积为10L的密闭容器中发生反应的过程如图所示,下列说法正确的是( )
已知反应:A(s)+3B(g)?2C(g)△H<0,在体积为10L的密闭容器中发生反应的过程如图所示,下列说法正确的是( )| A. | 前4 min,用A表示反应速率为v(A)=0.005mol/(L•min) | |
| B. | X曲线表示B的物质的量随时间变化的关系 | |
| C. | 第t1min时说明反应达到了平衡 | |
| D. | 第10 min时,可能采取了降温 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 反应叙述 | 产物图示 |
| A | NaOH溶液与SO2 反应时溶液中的溶质 |  |
| B | NaAlO2溶液与盐酸反 应后铝元素的存在形式 |  |
| C | Fe和稀HNO3反应 后,铁元素的存在形式 | 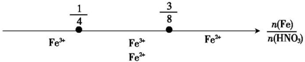 |
| D | Fe在Cl2中的燃烧产物 |  |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.8×l0-5 | 4.9×l0-10 | K1=4.3×l0-7, K2=5.6×l0-11 |
| A. | CH3COO-、CO32-、CN-在溶液中可以大量共存 | |
| B. | 向食醋中加入水可使CH3COOH的电离平衡向电离方向移动 | |
| C. | 相同物质的量浓度的Na2CO3和NaCN溶液,前者pH较大 | |
| D. | pH=a的上述3种酸溶液,加水后溶液的pH相同,则醋酸中加入的水最多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t℃ | 700 | 800 | 850 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | O.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com