
| A. | 在偏铝酸钠溶液中滴入少量的碳酸氢钠溶液HCO3-+AlO2-+H2O=Al(OH)3↓+CO2↑ | |
| B. | 向明矾溶液中逐滴加入Ba(OH)2溶液至Al3+离子刚好完全沉淀2Al3++6OH-+3Ba2++3SO42-=2Al(OH)3↓+3BaSO4↓ | |
| C. | 在碳酸氢镁溶液中逐滴加入澄清石灰水至过量Ca2++Mg2++2HCO3-+2OH-=CaCO3↓+2H2O+MgCO3↓ | |
| D. | 氢氧化铁固体溶于氢碘酸 Fe(OH)3+3H+=Fe3++3H2O |
分析 A.偏铝酸钠溶液中滴入少量的碳酸氢钠,生成氢氧化铝沉淀和碳酸钠;
B.明矾溶液中n(Al3+):n(SO42-)=1:2,设硫酸铝为1mol,应加入1.5molBa(OH)2;
C.在碳酸氢镁溶液中逐滴加入澄清石灰水至过量生成碳酸钙沉淀和氢氧化镁沉淀;
D.三价铁离子有氧化性,能够氧化碘离子.
解答 解:A.偏铝酸钠溶液中滴入少量的碳酸氢钠,生成氢氧化铝沉淀和碳酸钠,其反应离子方程式为:HCO3-+AlO2-+H2O=Al(OH)3↓+CO32-,故A错误;
B.向明矾溶液中逐滴加入Ba(OH)2溶液至Al3+离子刚好完全沉淀,明矾溶液中n(Al3+):n(SO42-)=1:2,设硫酸铝为1mol,应加入1.5molBa(OH)2,离子方程式应为2Al3++6OH-+3Ba2++3SO42-=2Al(OH)3↓+3BaSO4↓,故B正确;
C.在碳酸氢镁溶液中逐滴加入澄清石灰水至过量生成碳酸钙沉淀和氢氧化镁沉淀,其反应的离子方程式为:Ca2++Mg2++HCO3-+3OH-=CaCO3↓+H2O+Mg(OH)2↓,故C错误;
D.三价铁离子能氧化碘离子,离子方程式为2Fe(OH)3+6H++2I-=I2+2Fe2++6H2O,故D错误.
故选B.
点评 本题考查了离子方程式的书写,题目难度不大,熟悉反应的实质是解题关键,注意化学式的拆分、反应物用量对化学反应的影响,侧重于考查学生对基础知识的应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 凡是吸热反应都需要加热 | |
| B. | 物质的化学变化都伴随着能量变化 | |
| C. | 表示中和热的热化学方程式:NaOH+HCl═NaCl+H2O△H=-57.3 kJ•mol-1 | |
| D. | 等质量的硫蒸气和硫固体分别完全燃烧,前者的反应热比后者大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
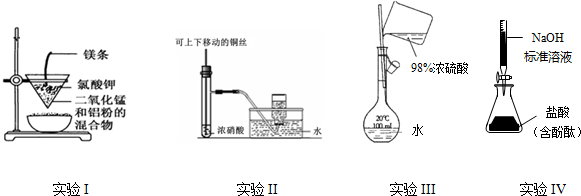
| A. | 实验I:制备金属锰 | |
| B. | 实验II:制备并收集NO2 | |
| C. | 实验III:配置一定的物质的量浓度的稀硫酸溶液 | |
| D. | 实验IV:测定未知盐酸的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 饱和NaCl(aq)$\stackrel{NH_{3},CO_{2}}{→}$ NaHCO3$\stackrel{△}{→}$Na2CO3 | |
| B. | Mg3N2$\stackrel{H_{2}O}{→}$Mg(OH)2$\stackrel{△}{→}$MgO | |
| C. | Mg$→_{加热}^{SO_{2}}$MgO | |
| D. | MgCl2(aq)$\stackrel{蒸发浓缩}{→}$MgCl2•6H2O$\stackrel{熔融电解}{→}$Mg |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
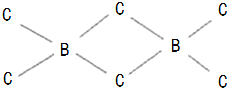
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
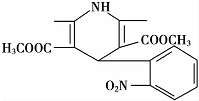
| A. | 该化合物的分子式为C17H17N2O6 | |
| B. | 该化合物的分子中含有三种不同的官能团 | |
| C. | 该化合物能与氢气发生加成反应,但不能与溴的四氯化碳溶液反应 | |
| D. | 该化合物能发生水解反应、聚合反应、取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图是一种锂钒氧化物热电池装置,电池总反应为xLi+LiV3O8=Li1+xV3O8.工作时,需先引发铁和氯酸钾反应使共晶盐融化.已知:Li熔点181℃,LiCl-KCl共晶盐熔点352℃.下列说法正确的是( )
如图是一种锂钒氧化物热电池装置,电池总反应为xLi+LiV3O8=Li1+xV3O8.工作时,需先引发铁和氯酸钾反应使共晶盐融化.已知:Li熔点181℃,LiCl-KCl共晶盐熔点352℃.下列说法正确的是( )| A. | 整个过程的能量转化只涉及化学能转化为电能 | |
| B. | 放电时正极反应为:Li1+xV3O8-xe?═LiV3O8+xLi+ | |
| C. | 放电时Cl?移向LiV3O8电极 | |
| D. | Li-Si合金熔点高于352℃ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com