

分析 (1)已知:①.H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H1=-241.8kJ•mol-1
②.C(s)+$\frac{1}{2}$O2(g)═CO(g)△H2=-110.5kJ•mol-1
根据盖斯定律,②-①可得:C(s)+H2O(g)=CO(g)+H2(g),△H=△H2-△H1;
(2)①M点时,CO转化率为50%,则参加反应的n(CO)=10mol×50%=5mol,还剩余5molCO,根据方程式知,还剩余n(H2)=20mol-5mol×2=10mol,生成n(CH3OH)=5mol;
N点时,CO转化率为70%,参加反应的n(CO)=10mol×70%=7mol,还剩余3molCO,根据方程式知,还剩余n(H2)=20mol-7mol×2=6mol,生成n(CH3OH)=7mol;
②化学平衡常数只与温度有关,相同温度时其平衡常数相等,升高温度平衡向逆反应方向移动,其平衡常数减小;
(3)根据图象知,硝酸根离子得电子发生还原反应,则b为负极、a为正极,阴极上硝酸根离子得电子生成氮气和水;
(4)根据溶度积常数Ksp(CaF2)=1.5×10-10,计算溶液中溶液中最小c(F-),溶液中c(H+)≈c(F-)=10-4mol/L,再根据电离常数Ka(HF)=3.6×10-4计算溶液中c(HF),再根据n(HF)=[c(F-)+c(HF)]×V计算.
解答 解:(1)已知:①.H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H1=-241.8kJ•mol-1
②.C(s)+$\frac{1}{2}$O2(g)═CO(g)△H2=-110.5kJ•mol-1
根据盖斯定律,②-①可得:C(s)+H2O(g)═CO(g)+H2(g)△H=+131.3kJ•mol-1,
故答案为:C(s)+H2O(g))═CO(g)+H2(g)△H=+131.3kJ•mol-1;
(2)①M点时,CO转化率为50%,则参加反应的n(CO)=10mol×50%=5mol,还剩余5molCO,根据方程式知,还剩余n(H2)=20mol-5mol×2=10mol,生成n(CH3OH)=5mol;
N点时,CO转化率为70%,参加反应的n(CO)=10mol×70%=7mol,还剩余3molCO,根据方程式知,还剩余n(H2)=20mol-7mol×2=6mol,生成n(CH3OH)=7mol,
所以容器中总物质的物质的量之比为:n(M)总:n(N)总=(5+10+5)mol:(3+6+7)mol=10:8,
故答案为:10:8;
②化学平衡常数只与温度有关,相同温度时其平衡常数相等,升高温度平衡向逆反应方向移动,其平衡常数减小,根据图象知,温度:M=N<Q,则若M、N、Q三点的平衡常数KM、KN、KQ的大小关系为KM=KN>KQ,故答案为:KM=KN>KQ;
(3)根据图象知,硝酸根离子得电子发生还原反应,则b为负极、a为正极,阴极上硝酸根离子得电子生成氮气和水,电极反应式为2NO3-+12H++10e-=N2+6H2O,
故答案为:a;2NO3-+12H++10e-=N2+6H2O;
(4)现向1000L 1.5×10-2mol/L CaCl2溶液中通入氟化氢气体,当开始出现白色沉淀时,溶液中最小c(F-)=$\sqrt{\frac{1.5×1{0}^{-10}}{1.5×1{0}^{-2}}}$mol/L=10-4mol/L,溶液中c(H+)≈c(F-)=10-4mol/L,电离常数Ka(HF)=3.6×10-4,则溶液中c(HF)=$\frac{1{0}^{-4}×1{0}^{-4}}{3.6×1{0}^{-4}}$mol/L=$\frac{1}{3.6}$×10-4mol/L,故通入的氟化氢为1000L×(10-4mol/L+$\frac{1}{3.6}$×10-4mol/L)=0.128,
故答案为:0.128.
点评 本题考查化学平衡计算、热化学方程式书写、原电池、溶度积于电离平衡常数有关计算等,是对学生综合能力的考查,难度中等.


科目:高中化学 来源: 题型:解答题
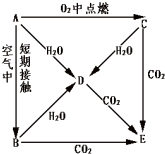 A、B、C、D、E五种物质都含1~18号元素中的某一元素,它们按图所示关系相互转化,己知A金属为单质.
A、B、C、D、E五种物质都含1~18号元素中的某一元素,它们按图所示关系相互转化,己知A金属为单质.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 17 g | B. | 5.1 g | C. | 10.2 g | D. | 34 g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 改变条件,反应物的转化率增大,平衡常数也一定增大 | |
| B. | 反应2NO2(g)═N2O4(g)△H<0,升高温度该反应平衡常数增大 | |
| C. | 对于给定可逆反应,温度一定时,其正、逆反应的平衡常数相等 | |
| D. | 平衡常数为K=$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$的反应,化学方程式为CO2+H2$?_{加热}^{催化剂}$CO+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在一定温度下,向2L体积固定的密闭容器中加入1molHI,2HI(g)═H2(g)+I2(g)△H>0,H2的物质的量随时间的变化如图示,下列说法正确的是( )
在一定温度下,向2L体积固定的密闭容器中加入1molHI,2HI(g)═H2(g)+I2(g)△H>0,H2的物质的量随时间的变化如图示,下列说法正确的是( )| A. | 该温度下,反应的平衡常数是$\frac{1}{8}$ | |
| B. | 0~2min内的HI的平均反应速率为0.05mol•L-1•min-1 | |
| C. | 恒压下向该体系中加入N2,平衡不移动,反应速率不变 | |
| D. | 升高温度,平衡向正反应方向移动,只有正反应速率加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用铝槽车盛运浓硫酸--强氧化性 | |
| B. | 久置浓硝酸变黄--不稳定性 | |
| C. | 浓硫酸能使蔗糖变黑并膨胀--吸水性 | |
| D. | 用稀硝酸洗涤做过银镜反应的试管--强氧化性和酸性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com