
分析 一般家用铅蓄电池作小汽车的所用的电池,一般手机所用的电池为锂电池或镍氢电池;为加快双氧水分解速率,可以加入一定的催化剂,如氯化铁溶液等;同系物指结构相似,分子组成上相差一个或若干个CH2原子团的互称.
解答 解:(1)一般家用铅蓄电池作小汽车的所用的电池,一般手机所用的电池为锂电池或镍氢电池,
故答案为:铅蓄电池;锂电池或镍氢电池;
(2)为加快双氧水分解速率,可以加入一定的催化剂,如氯化铁溶液或新鲜的动物肝脏或新鲜的土豆或CuO、Fe2O3,
故答案为:氯化铁溶液或新鲜的动物肝脏或新鲜的土豆或CuO、Fe2O3;
(3)同系物指结构相似,分子组成上相差一个或若干个CH2原子团的互称,乙烷和丙烷互称为同系物,
故答案为:同系物.
点评 本题考查了化学与生活的基本常识,掌握影响反应速率的因素,同系物的判断,为基础题,难度不大.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它是一种共价化合物 | |
| B. | 在加热时此化合物可以分解为PH3和HI | |
| C. | 这种化合物不能跟碱反应 | |
| D. | 该化合物中每个原子的最外层都满足8电子稳定结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol酸与1mol碱发生中和反应时所释放的热量称为中和热 | |
| B. | 放热的反应在常温下不一定很容易发生 | |
| C. | 化学反应是放热还是吸热,取决于反应物和生成物所具有的总能量的相对大小 | |
| D. | 化学反应的本质是旧键的断裂和新键的形成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L一氯甲烷中有5 NA个原子 | |
| B. | 17.6 g丙烷中含有3.2 NA个极性共价键 | |
| C. | 13 g苯和苯乙烯的混合液体中有2 NA个原子 | |
| D. | 分子数为NA的CO、C2H4混合气体体积约为22.4 L,质量为28 g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最简式相同的各物质必定互为同分异构体,互为同分异构体的物质最简式也相同 | |
| B. | 组成元素相同且各元素质量分数也相同的一定互为同分异构体 | |
| C. | 有相同的分子通式且分子组成上相差一个或若干个CH2原子团的物质一定互为同系物 | |
| D. | 分子式相同的不同有机物,一定是同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 利用I2O5可消除CO污染,反应为I2O5(s)+5CO(g)?5CO2(g)+I2(s);不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入2molCO,测得CO2气体体积分数φ(CO2)随时间t变化曲线如图所示.下列说法正确的是( )
利用I2O5可消除CO污染,反应为I2O5(s)+5CO(g)?5CO2(g)+I2(s);不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入2molCO,测得CO2气体体积分数φ(CO2)随时间t变化曲线如图所示.下列说法正确的是( )| A. | b点时,CO的转化率为20% | |
| B. | 容器内的压强保持恒定,表明反应达到平衡状态 | |
| C. | b点和d点的化学平衡常数:Kb>Kd | |
| D. | 0到0.5min反应速率V(CO)=0.3mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
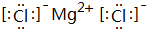 ,其中所含化学键的类型是离子键.
,其中所含化学键的类型是离子键.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com