
【题目】(1)基态原子变成激发态原子产生的光谱叫_______光谱。第四周期中基态原子的M层电子全满的元素位于周期表的_______区,其中未成对电子数为1的有_______种。
(2)已知液态二氧化硫可以发生类似于水的自身电离2SO2(l)![]() SO2++SO32-,SO2+中的σ键和π键数目比为_______,写出一种与SO2+互为等电子体的单质分子_______。
SO2++SO32-,SO2+中的σ键和π键数目比为_______,写出一种与SO2+互为等电子体的单质分子_______。
(3)氯化钠的晶胞如图所示,钠离子周围紧邻的氯离子形成的几何构型是_______。若钠离子和氯离子的半径分别是apm和bpm,则氯化钠晶体的空间利用率是_______。

【答案】 吸收 ds和p 3 1∶2 N2 (正) 八面体 
【解析】(1)基态原子变成激发态原子产生的光谱叫吸收光谱。第四周期中基态原子的M层电子全满的元素最后排布的电子排布在4s或4p上,价电子为3d 4s或4s4p,因此该元素位于周期表的ds和p区,其中未成对电子数为1的有4s1、4p1或4p5,共3种,故答案为:吸收;ds和p;3;
(2)与SO2+互为等电子体的单质分子为氮气,因此SO2+的结构与氮气相似,σ键和π键数目比为1:2,故答案为:1∶2; N2;
(3)氯化钠是离子晶体,配位数均是6,每个钠离子周围与它最接近且距离相等的氯离子有6个,每个钠离子周围与它最接近且距离相等的钠离子有12个,每个钠离子周围紧邻的氯离子相连接而成的空间几何体为正八面体;晶胞中共含有4个Na+和4个Cl-,体积为: ![]() π(a3+b3)×4,晶胞的边长为2a+2b,晶胞体积为(2a+2b)3,氯化钠晶体中离子的空间利用率为
π(a3+b3)×4,晶胞的边长为2a+2b,晶胞体积为(2a+2b)3,氯化钠晶体中离子的空间利用率为 ×100%=
×100%= ×100%,故答案为:正八面体;
×100%,故答案为:正八面体;  ×100%。
×100%。


 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:
【题目】A、B、C是三种元素的原子,质子数都小于18。A原子与B原子的最外层电子数都是6,A原子与C原子的核外电子层数都为3, C原子的质子数比A少4。回答下列问题:
(1)A、B、C的元素名称分别为________、________、________;
(2)A的离子结构示意图为________;
(3)元素A的一种质量数为32的核素,与元素B的一种核素构成微粒为AB42-,1mol AB42-的质量为104g,则元素B的该核素中的中子数为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如右图所示(夹持仪器已略去)。
(1)实验前,应先检查装置的 ;实验中产生的尾气应通入 溶液进行处理。
(2)实验过程中需要配制100 mL l mo1·L-1 FeCl3溶液,所需要的玻璃仪器有:烧杯、量筒、玻璃棒、 ;实际配制过程中,常先将FeCl3固体完全溶于适量稀盐酸中,再加水稀释,此特殊操作的目的是____。
(3)该小组同学向5 mL l mo1·L-1 FeCl3溶液中通入足量的SO2,溶液最终呈浅绿色,写出其反应的离子方程式 。再打开分液漏斗活塞,逐滴加入煮沸冷却后的NaOH稀溶液,则试管B中产生的实验现象是 。
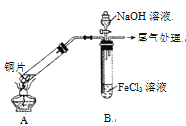
(4)该小组同学在(3)中实验时,发现溶液变为浅绿色需要较长时间,在此期间同学们观察到的现象是溶液由棕黄色变成红棕色,没有观察到丁达尔效应,最终溶液呈浅绿色。
【查阅资料】Fe(HSO3)2+在溶液中呈红棕色且具有较强的还原性,能被Fe3+氧化为SO42-。则Fe(HSO3)2+与Fe3+在溶液中反应的离子方程式是 。
(5)若实验中用5 mL一定浓度的浓H2SO4与适量Cu片充分反应,实验结束后,测得产生SO2的体积在标准状况下为672 mL,向已冷却的A试管溶液中加入4 mo1·L-1的NaOH溶液30 mL时,恰好使Cu2+完全沉淀。则所用浓H2SO4浓度为____。(忽略过程中溶液的体积变化)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,氧化剂和还原剂的物质的量之比最大的是().
A. 铜和稀硝酸 3Cu+8HNO3(稀)=2NO↑+3Cu(NO3)2+4H2O
B. 氯气和氨气 3Cl2+8NH3=N2+6NH4C1
C. 氢气和氧化铁 3H2+Fe2O3![]() 2Fe+3H2O
2Fe+3H2O
D. 二氧化锰和盐酸 MnO2+4HC1(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一块铁的“氧化物”样品,用140mL5.0mol·L-1盐酸恰好将之完全溶解,所得溶液还能吸收0.025molCl2,恰好使其中的Fe2+全部转变为Fe3+,则该样品可能的化学式为( )
A. Fe2O3 B. Fe3O4 C. Fe4O5 D. Fe5O7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学概念在逻辑上存在如下关系:

对下列概念的说法正确的是( )
A. 化合物与电解质属于重叠关系 B. 溶液与胶体属于并列关系
C. 化合物与碱性氧化物属于交叉关系 D. 物质的量与物质的质量属于包含关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合金贮氢材料具有优异的吸收氢性能,在配合氢能的开发中起到重要作用。
(1)一定温度下,某贮氢合金(M)的贮氢过程如图所示,纵轴为平衡时氢气的压强(P),横轴表示固相中氢原子与金属原子的个数比(H/M)。

在OA段,氢溶解于M中形成固溶体MHx,随着氢气压强的增大,H/M逐惭增大;在AB段,MHx与氢气发生氢化反应生成氢化物MHy,氢化反应方程式为:zMHx(s)+H2(g)==ZMHy(s) △H(Ⅰ);在B点,氢化反应结束,进一步增大氢气压强,H/M几乎不变。反应(I)中z=________ (用含x和y的代数式表示)。温度为T1时,2g某合金4min内吸收氢气240mL,吸氢速率v=___________mL·g-lmin-1。反应的焓变△H1_____0(填“>”“<”或“=”)。
(2)η表示单位质量贮氢合金在氢化反应阶段的最大吸氢量占其总吸氢量的比例,则温度为Tl、T2时,η(T1)____η(T2)(填“>”“<”或“=”)。当反应(I )处于图中a点时,保持温度不变,向恒容体系中通入少量氢气,达到平衡后反应(I)可能处于图中的 ________点(填“b” “c”或“d”),该贮氢合金可通过________或____的方式释放氢气。
(3)贮氢合金ThNi5可催化由CO、H2合成CH4的反应,温度为T时,该反应的热化学方程式为___________。己知温度为 T 时:CH4(g)+2H2O=CO2(g)+4H2(g) △H=+165kJ/mol CO(g)+H2O(g)=CO2(g)+H2(g) △H=-41kJ/mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是
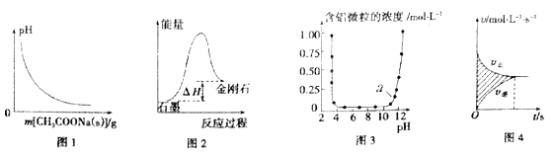
A. 图1表示向0.1mol/L CH3COOH溶液中逐步加入CH3COONa固体后,溶液pH的变化
B. 图2表示石墨转化为金刚石反应过程中的能量变化,可判断石墨比金刚石稳定
C. 图3表示Al3+与OH-反应时溶液中含铝微粒浓度变化曲线,图中a点溶液中大量存在Al3+
D. 图4表示某可逆反应的v-t曲线,图中阴影部分面积的含义是(v正-v逆)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com