
| A. | CS2的比例模型: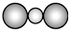 | |
| B. | H2O2的电子式: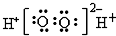 | |
| C. | 氯离子(Cl-)的结构示意图: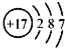 | |
| D. | 基态镁原子的电子排布图:1s22s22p63s2 |
分析 A.CS2类比二氧化碳得知,此分子为直线形,且S原子半径大于C原子;
B.双氧水为共价化合物,电子式中不能标出电荷;
C.氯离子的最外层达到8电子稳定结构;
D.镁原子的核外电子总数为12,最外层为2个电子.
解答 解:A.CS2类比二氧化碳得知,此分子为直线形,且S原子半径大于C原子,故比例模型为: ,故A正确;
,故A正确;
B.双氧水为共价化合物,分子中存在两个氧氢键和一个O-O键,双氧水的电子式为: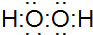 ,故B错误;
,故B错误;
C.氯离子的核电荷数为17,核外电子总数为18,其正确的离子结构示意图为: ,故C错误;
,故C错误;
D.基态镁原子的核外电子总数为12,其电子排布图为:1s22s22p63s2,故D正确;
故选D.
点评 本题考查了常见化学用语的表示方法,题目难度中等,涉及电子式、电子排布图、离子结构示意图、比例模型等知识,明确常见化学用语的书写原则为解答关键,试题培养了学生的规范答题能力.


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:解答题
 超导材料是材料研究的热点之一.我国化学家赵忠贤1987年发现了温度为110K的超导材料-铊钡钙铜氧系合金.请回答下列问题:
超导材料是材料研究的热点之一.我国化学家赵忠贤1987年发现了温度为110K的超导材料-铊钡钙铜氧系合金.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯、乙烯分别使溴水褪色 | |
| B. | 溴乙烷分别在NaOH的水溶液、NaOH的醇溶液中反应 | |
| C. | 乙烯、甲苯使酸性KMnO4溶液褪色 | |
| D. | 苯、甲苯在一定条件下与混酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在导管口处点燃 | B. | 通入足量高锰酸钾溶液中 | ||
| C. | 通入足量溴水中 | D. | 在一定条件下与H2反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在氯化钠晶体中每个Na+(或Cl-)周围都紧邻8个Cl-(Na+) | |
| B. | 原子晶体中只存在共价键 | |
| C. | 离子晶体和分子晶体在熔化时,化学键都被破坏 | |
| D. | 熔融状态下能导电的晶体一定是金属晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | a、b不可能是同种材料的电极 | |
| B. | 该装置可能是电解池,电解质溶液为稀H2SO4 | |
| C. | 该装置可能是原电池,电解质溶液为稀HNO3 | |
| D. | 反应一段时间后,断开电路,向溶液中通入H2可使溶液复原 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-110.5 kJ/mol | |
| B. | H2(g)+Cl2(g)=2HCl(g)△H=-184.6 kJ/mol | |
| C. | H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8 kJ/mol | |
| D. | C8H18(l)+$\frac{25}{2}$O2(g)=8CO2(g)+9H2O(l)△H=-5518 kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com