
已知NaCl的摩尔质量为58.5 g·mol-1,其晶体密度为d g·cm-3,若图中钠离子与最接近的氯离子的核间距离为a cm,那么阿伏加德罗常数的值可表示为 ( )。
A.117a3d B.58.5/(2a3d)
C.234/(a3d) D.58.5/(4a3d)
科目:高中化学 来源: 题型:
某未知溶液可能含Cl-、CO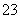 、Na+、SO
、Na+、SO 、Al3+,将溶液滴在蓝色石蕊试纸上,试纸变红。取少量试液,滴加硝酸酸化的氯化钡溶液,有白色沉淀生成;在上层清液中滴加硝酸银溶液,产生白色沉淀。下列判断合理的是( )
、Al3+,将溶液滴在蓝色石蕊试纸上,试纸变红。取少量试液,滴加硝酸酸化的氯化钡溶液,有白色沉淀生成;在上层清液中滴加硝酸银溶液,产生白色沉淀。下列判断合理的是( )
A.一定有Cl- B.一定有SO
C.一定没有Al3+ D.可能有CO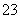
查看答案和解析>>
科目:高中化学 来源: 题型:
下列表示对应化学反应的离子方程式正确的是( )
A.用KIO3氧化酸性溶液中的KI:5I-+IO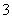 +3H2O===3I2+6OH-
+3H2O===3I2+6OH-
B.向NH4HSO3溶液中加过量的NaOH溶液并加热:NH +OH-
+OH-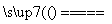 NH3↑+H2O
NH3↑+H2O
C.将过量SO2通入冷氨水中:SO2+NH3·H2O===HSO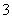 +NH
+NH
D.Ba(OH)2溶液中逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的OH-恰好反应一半时:Ba2++2OH-+2H++SO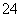 ===BaSO4↓+2H2O
===BaSO4↓+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
某高聚物的结构如图所示,下列说法正确的是(  )
)

A.该高聚物为加聚产物
B.该高分子为体型高分子
C.该高分子的单体有6种
D.该高分子中含有酯基、羟基、羧基
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于晶体的说法,一定正确的是 ( )。
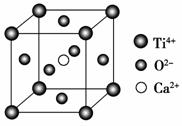
CaTiO3的晶体结构模型(图中Ca2+、O2-、
Ti4+分别位于立方体的体心、面心和顶角)
A.分子晶体中都存在共价键
B.如上图,CaTiO3晶体中每个Ti4+和12个O2-相紧邻
C.SiO2晶体中每个硅原子与两个氧原子以共价键相结合
D.金属晶体的熔点都比分子晶体的熔点高
查看答案和解析>>
科目:高中化学 来源: 题型:
元素的原子半径在周期表中呈现周期性变化的根本原因是( )
A.原子的相对原子质量呈现周期性变化
B.元素的化合价呈现周期性变化
C.原子的性质呈现周期性变化
D.元素原子的核外电子排布呈周期性变化
查看答案和解析>>
科目:高中化学 来源: 题型:
根据前四周期元素原子核外电子排布特点,回答下列问题:
(1)外围电子层有2个未成对电子的有________;有3个未成对电子的有________。
(2)未成对电子数与周期数相等的元素有________。
查看答案和解析>>
科目:高中化学 来源: 题型:
回答下列问题:
(1)已知元素M是组成物质NH4Al(SO4)2的一种元素。元素M的气态原子逐个失去第1个至第4个电子所需能量(即电离能,用符号I1至I4表示)如下表所示:
| I1 | I2 | I3 | I4 | |
| 电离能(kJ·mol-1) | 578 | 1 817 | 2 745 | 11 578 |
元素M是____________(填写元素符号)。
(2)硫原子核外有________种不同运动状态的电子,有________种不同形状的电子云。
(3)请用一个事实证明氧气的氧化性比硫的氧化性强:__________________________。
(4)写出碳原子最外层电子的电子排布图________________,该化学用语不能表达出碳原子最外层电子的________(填字母)。
a.电子层 b.原子轨道
c.所有电子云的伸展方向 d.自旋状态
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com