
|
常温下,在100 mL 1 mol/L的NaHCO3溶液中,加入Xmol的Ba(OH)2固体(假设溶液体积和温度保持不变).以下关于溶液中c(CO | |
A. |
当X=0.025时,溶液中有HCO3-和CO32-,且2C(CO32-)=C(HCO3-) |
B. |
当X=0.05时,溶液中有HCO3-和CO32-,且C(CO32-)>C(HCO3-) |
C. |
当X=0.06时,溶液中HCO3-、CO32-浓度都减小了 |
D. |
当X=0.1时,溶液PH增大,沉淀达到最大值 |
科目:高中化学 来源: 题型:
 水的电离平衡曲线如图所示.?
水的电离平衡曲线如图所示.?查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| 11m-3b |
| 11m |
| 11m-3b |
| 11m |
m-
| ||
| m |
m-
| ||
| m |
 (5)经过大家的讨论,决定采用下图装置(干燥管中试剂为无水氯化钙,锥形瓶中为mg铁炭合金和足量稀硫酸.)和其他常用实验仪器测定某些数据即可.为了快速测算出铁的质量分数,最简便的实验操作是
(5)经过大家的讨论,决定采用下图装置(干燥管中试剂为无水氯化钙,锥形瓶中为mg铁炭合金和足量稀硫酸.)和其他常用实验仪器测定某些数据即可.为了快速测算出铁的质量分数,最简便的实验操作是查看答案和解析>>
科目:高中化学 来源:2012-2013学年安徽省马鞍山市高三第三次教学质量检测化学试卷(解析版) 题型:选择题
常温下,向100 mL 0.01 mol·L-1HA溶液中逐滴加入0.02 mol·L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。下列叙述正确的是
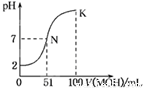
A.HA为弱酸,MOH为强碱
B.pH=7时,HA与MOH恰好完全反应
C.在N点,c(A-)=c(M+) + c(MOH)
D.在K点,c(M+)>c(A-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:
酸、碱、盐都是电解质,在水中都能电离出离子。根据下列化合物:(1)NaOH(2)CH3COOH(3)NH4Cl(4)NH3·H2O(5)CH3COONa请回答下列问题: (1)上述几种电解质中属于弱电解质的是 ,溶液呈酸性的有 (填序号) (2)常温下0.01mol/L NaOH溶液的PH= ;PH=11的CH3COONa溶液中由水电离产生的c(OH-) = (3)用离子方程式表示NH4Cl溶液呈酸性的原因 ,其溶液中离子浓度按由大到小的顺序为 (4)将等PH等体积的NaOH和NH3·H2O分别稀释m倍和n倍,稀释后两溶液的PH仍相等,则m n (填“大于、等于、小于”) (5)常温下,向100 mL 0.01 mol·L-1HA溶液中逐滴加入0.02 mol·L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。回答下列问题: 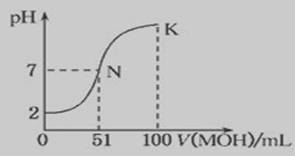
①由图中信息可知HA为________酸(填“强”或“弱”),理由是____________ 。
② K点对应的溶液中,c(M+)+c(MOH)________2c(A-)(填“>”、“<”或“=”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com