
分析 ①蛋白质灼烧产生烧焦羽毛的气味;
②依据盐类水解的性质及应用,次氯酸的氧化性能够使蛋白质变性解答;
③玻璃和水泥工业都属于硅酸盐工业,生产玻璃和水泥都要用到石灰石;潮湿的环境下更容易形成原电池;
④依据铝在空气中易形成致密的氧化铝保护膜分析铝不易生锈的原因;天然橡胶通过硫化措施可增大强度和弹性.
解答 解:①蛋白质灼烧产生烧焦羽毛的气味,此性质可以用于鉴别真假羊毛衫的方法是先取样,再点燃闻气味;
故答案为:点燃闻气味;
②明矾电离产生的铝离子水解生成具有吸附性的氢氧化铝胶体,可以吸附水中固体杂质颗粒,在净水过程中,明矾作为混凝剂,氯气与水反应生成的次氯酸具有强的氧化性,具有杀菌消毒作用;
故答案为:混凝; 消毒;
③.玻璃和水泥工业都属于硅酸盐工业,生产玻璃的原料是纯碱、石灰石和石英,生产水泥的原理是黏土和石灰石,所以生产玻璃和水泥都要用到的原料是石灰石;潮湿的环境下更容易形成原电池,是金属发生电化学腐蚀;
故答案为:石灰石;电化学;
④金属铝在空气中能与氧气反应生成致密的氧化铝保护膜,从而阻止铝进一步被氧化,所以金属铝不易生锈,天然橡胶通过硫化措施可增大强度和弹性;
故答案为:表面有一层致密的氧化铝薄膜;硫化.
点评 本题是一道综合题,考查内容较多,涉及蛋白质的鉴别、明矾净水、次氯酸的强氧化性、玻璃成分等知识,平时注意基础知识的积累,题目较简单,侧重于化学知识与生产生活的联系,考查了学生对所学知识的应用能力.


 优生乐园系列答案
优生乐园系列答案科目:高中化学 来源: 题型:选择题
 现在污水治理越来越引起人们重视,可以通过
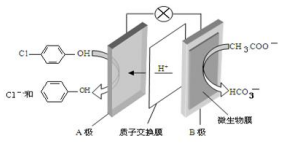
现在污水治理越来越引起人们重视,可以通过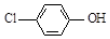 膜电池除去废水中的乙酸钠和对氯苯酚( ),其原理如图所示,下列说法正确的是.
膜电池除去废水中的乙酸钠和对氯苯酚( ),其原理如图所示,下列说法正确的是.| A. | 电流方向从B极沿导线经小灯泡流向A极 | |
| B. | A极的电极反应式为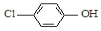 +e-═Cl-+ +e-═Cl-+ | |
| C. | 当外电路中有0.2mole-转移时,通过质子交换膜的H+的个数为0.1NA | |
| D. | B极为电池的正极,发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 酒精溶液可以使蛋白质变性,酒精纯度越高杀菌消毒效果越好 | |
| B. | 在烟花中加入某些金属元素,使焰火更加绚丽多彩 | |
| C. | 苏打水呈弱碱性,可以舒缓胃酸分泌过多时的不适感 | |
| D. | 在葡萄酒中添加微量二氧化硫作抗氧化剂,使酒保持良好品质 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
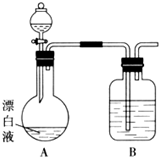 实验小组同学看到一则报道:某造纸厂误将槽车中漂白液(NaCl和NaClO的混合液)倒入盛放饱和KAl(SO4)2溶液的池中,造成中毒事件.该小组同学为探究中毒原因进行了如下实验.
实验小组同学看到一则报道:某造纸厂误将槽车中漂白液(NaCl和NaClO的混合液)倒入盛放饱和KAl(SO4)2溶液的池中,造成中毒事件.该小组同学为探究中毒原因进行了如下实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH(固体) | B. | 冰醋酸 | C. | HCl | D. | CH3COONa(固体) |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
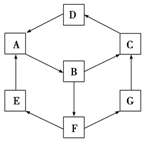 如图是无机物A~G在一定条件下的转化关系(部分产物及反应条件未列出).已知:①A、B、C、D、G含有同种元素.
如图是无机物A~G在一定条件下的转化关系(部分产物及反应条件未列出).已知:①A、B、C、D、G含有同种元素.| 物质 | 纯A(单质) | B溶液 | C固体 | D固体 | G溶液 |
| 颜色 | 银白色 | 黄色 | 红褐色 | 红棕色 | 浅绿色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
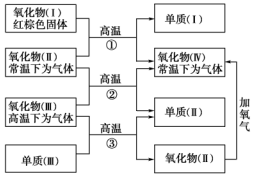 以下一些氧化物和单质之间可发生如图所示的反应:
以下一些氧化物和单质之间可发生如图所示的反应:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 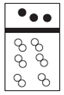 | B. |  | C. |  | D. |  |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com