
| c(酸)V(酸)-c(碱)V(碱) |
| V(酸)+V(碱) |
| c(酸)V(酸)-c(碱)V(碱) |
| V(酸)+V(碱) |
| 0.1mol/L(V2-V1) |
| V1+V2 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
 的结构单元.B分子比A分子多了
的结构单元.B分子比A分子多了查看答案和解析>>
科目:高中化学 来源: 题型:
 控制适宜条件,将反应Sn(s)+Pb2+(aq)?Sn2+(aq)+Pb(s)△H<0,设计成如图所示的原电池,一段时间后,灵敏电流计读数为零.则下列判断不正确的是( )
控制适宜条件,将反应Sn(s)+Pb2+(aq)?Sn2+(aq)+Pb(s)△H<0,设计成如图所示的原电池,一段时间后,灵敏电流计读数为零.则下列判断不正确的是( )| A、此时化学反应达到平衡状态 |
| B、若此时将Sn电极换成质量较大的Sn 电极后,电流计指针偏转,c(Pb2+)将减小 |
| C、若此时向左池加入少量的Sn(NO3)2固体,电流计指针偏转,Sn电极为正极 |
| D、若此时升高温度,c(Sn2+)将减小,Pb电极为负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、提高高锰酸钾的氧化能力,用盐酸酸化 |
| B、抑制Fe2+的水解,用稀硝酸酸化 |
| C、检验氯代烃中含氯,加碱溶液加热后,用硫酸酸化,再检验 |
| D、确认溶液中含有SO42-时,用盐酸酸化,再检验 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A元素原子的核外p电子总数比s电子总数少1 |
| B元素原子核外s电子总数与p电子总数相等,且不与A元素在同一周期 |
| C原子核外所有p轨道全满或半满 |
| D元素的主族序数与周期数的差为4 |
| E是前四周期中电负性最小的元素 |
| F在周期表的第七列 |


查看答案和解析>>
科目:高中化学 来源: 题型:
 室温下,将0.1mol?L-1盐酸滴入20mL 0.1mol?L-1氨水中,溶液pH随加入盐酸体积的变化曲线如图所示.
室温下,将0.1mol?L-1盐酸滴入20mL 0.1mol?L-1氨水中,溶液pH随加入盐酸体积的变化曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
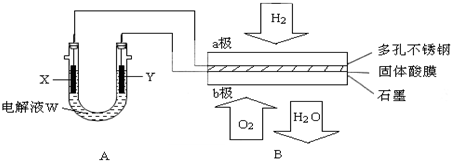
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①溶液中:c(CO32-)<c(H2CO3) |
| B、溶液的pH:②>① |
| C、溶液中的阴离子种类:②>① |
| D、②溶液中:c(HCO3-)>c(H2CO3) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com