
 �������糧�ͷų��Ĵ���NONOx��SO2��CO2��Ի��������Ⱦ����ȼú���������������������̼�ȴ�������ʵ�ֽ��ܼ��š��������õ�Ŀ�ģ�
�������糧�ͷų��Ĵ���NONOx��SO2��CO2��Ի��������Ⱦ����ȼú���������������������̼�ȴ�������ʵ�ֽ��ܼ��š��������õ�Ŀ�ģ����� ��1�����ݸ�˹���ɣ�������֪��ѧ��Ӧ����ʽ����ij��ϵ����ӻ�����������Ŀ�껯ѧ��Ӧ����ʽ���û�ѧ��Ӧ���ʱ伴Ϊ��֪��ѧ��Ӧ����ʽ���ʱ����ij��ϵ����ӻ�����õ���
��2�������ʵ���Ũ����ȵ��������Һ���������Һ��笠�����ˮ����Һ�����ԣ�笠�����Ũ��Խ����ˮ��̶�ԽС��
�������ˮ��ٽ�ˮ�ĵ��룬C1=10-4 mol/L��ϡ��������ˮ�ĵ��룬C2=c��OH-��=$\frac{1{0}^{-14}}{1{0}^{-4}}$=10-10 mol/L��
��3��������ӦʽΪCH3OH-6e-+H2O=CO2+6H+��������ӦʽΪO2+4H++4e-=2H2O�����յ缫��Ӧʽ���㣻
��� �⣺��1����֪��CH4��g��+4NO2��g��=4NO��g��+CO2��g��+2H2O��g����H1=-574kJ•mol-1��
CH4��g��+4NO��g��=2N2��g��+CO2��g��+2H2O��g����H2=-1160kJ•mol-1��
���ܻ�ѧ��Ӧ��һ����ɻ��Ƿּ�����ɣ��䷴Ӧ������ͬ�ģ����ø�˹���ɽ���ʽ��ӣ��ɵ�
2CH4��g��+4NO2��g��=2N2��g��+2CO2��g��+4H2O��g����H=-1734 kJ/mol��
��CH4��g��+2NO2��g��=N2��g��+CO2��g��+2H2O��g����H=-867 kJ•mol-1��
�ʴ�Ϊ��CH4��g��+2NO2��g��=N2��g��+CO2��g��+2H2O��g����H=-867 kJ/mol��
��2�������ʵ���Ũ����ȵ��������Һ���������Һ��笠�����ˮ����Һ�����ԣ�笠�����Ũ��Խ����ˮ��̶�ԽС��ǰ�ߵ�c��NH4+������ߵ�c��NH4+���Ĺ�ϵ�Ǵ�����2������ѡA��
�ʴ�Ϊ��A��
�������ˮ��ٽ�ˮ�ĵ��룬C1=10-4 mol/L��ϡ��������ˮ�ĵ��룬C2=c��OH-��=$\frac{1{0}^{-14}}{1{0}^{-4}}$=10-10 mol/L�������c1��c2�ı�ֵ����$\frac{1{0}^{-4}}{1{0}^{-10}}$=106��
�ʴ�Ϊ��106 ��
��3��������ӦʽΪCH3OH-6e-+H2O=CO2+6H+����ת��1mol����ʱ�������������$\frac{1}{6}$��12g=2g����Ҫ��1molH+ͨ�����ӽ���Ĥ�����Ҳ࣬��������1g��������ӦʽΪO2+4H++4e-=2H2O���Ҳ���������32g��$\frac{1}{4}$=8g������ת�ƹ�����1gH+���������������Һ������֮��Ϊ8g+1g+2g+1g=12g��
�ʴ�Ϊ��CH3OH+H2O-6e-=CO2��+6H+��12��
���� ���⿼���Ϊ�ۺϣ��漰��ѧƽ��ļ��㡢��ѧƽ����ƶ��Լ��绯ѧ֪ʶ���ۺϿ���ѧ���ķ��������ͼ������������յ缫����ʽ����д��ע�����ӽ���Ĥ�����ʣ��Ѷ��еȣ�


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �÷�Ӧ�����û���Ӧ | B�� | ��ԭ�ԣ�I2��Cl2 | ||
| C�� | �����ԣ�KClO3��KIO3 | D�� | I2 �������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| A | B | C | D | E |
| ����ʹ������Ȼ�̼��Һ��ɫ�� �ڱ���ģ��Ϊ��  ������ˮ��һ�������·�Ӧ����C | ����C��H����Ԫ����ɣ� �����ģ��Ϊ  | ����C��H��O����Ԫ����ɣ� ������Na��Ӧ����������NaOH��Һ��Ӧ�� ������E��Ӧ������Է�������Ϊ100������ | ����Է���������C��2�� ������C�������ɣ� | ����C��H��O����Ԫ����ɣ� �����ģ��Ϊ��  |
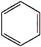 +Br2$\stackrel{FeBr_{3}}{��}$
+Br2$\stackrel{FeBr_{3}}{��}$ +HBr��
+HBr���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����ʵ�����ˮ����ˮ���е������� | |
| B�� | ����������ϩ�ͱ�ϩ�к��еĹ��õ��Ӷ��� | |
| C�� | ͬ�¡�ͬѹ��ͬ�����CO��NO���е������� | |
| D�� | �����ʵ���������ͭ�ֱ���������ȫ��Ӧ��ת�Ƶĵ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
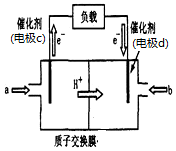
 �ҹ���ѧ�ҷ�����һ�ֿɿ��ˮ��أ�����Ϊ����DZͧ�Ĵ�����Դ���乤��ԭ����ͼ��ʾ�������й�˵������ȷ���ǣ�������
�ҹ���ѧ�ҷ�����һ�ֿɿ��ˮ��أ�����Ϊ����DZͧ�Ĵ�����Դ���乤��ԭ����ͼ��ʾ�������й�˵������ȷ���ǣ�������| A�� | ��ع���ʱ�����ӵ�����﮵缫�����ߡ�̼�缫 | |
| B�� | ˮ���������������ܼ����л�����ʿ���ˮ��Һ���� | |
| C�� | ����ܷ�ӦΪ2Li+2H2O=2LiOH+H2 | |
| D�� | ��װ�ò������ṩ���ܣ����ɵõ����ȼ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��0.1mol/L��NaHSO4��Һ�У�������������Ϊ0.2NA | |
| B�� | ��2gH2��88gCO2��36gH2O��ɵĻ�����壬�ܶ�Լ����ͬ״����O2�ܶȵ�0.79�� | |
| C�� | 1molAl������Na0H��Һ��Ӧ����H2�����Ϊ33.6L | |
| D�� | 56gFe����������S�����ڼ��������³�ַ�Ӧ��ת�Ƶ�����Ϊ3NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Ԫ�شӻ���̬��Ϊ����̬����Ԫ��һ������ԭ | |
| B�� | ���Ͻ�ȴ������۵���� | |
| C�� | ����FeCl3��Һʱ��ͨ������Һ�м������ĵ����� | |
| D�� | Ư��Ӧ���������ܷⱣ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A | B | C | D |
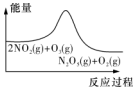 |  |  |  |
| ƽ������£�NO2�������� | 0��2s�ڣ�v��O2��=0.2mol•L-1•s-1 | v����b�㣾a�㣬b�㣺v����v�� | ���£�t1ʱ�ٳ���O3 |
| A�� | .A�� | B�� | .B | C�� | .C | D�� | .D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Na2CO3 •H2O | B�� | Na2CO3 •2H2O | C�� | Na2CO3 | D�� | ������ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com