
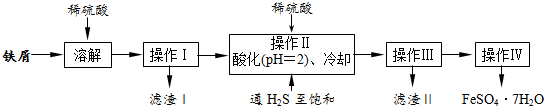
���� ��м����ϡ�����������������������������˺�õ���Һ������Һ����ϡ�����ữ����ͨ�����⣬������SnS��������ֹ�������ӱ����������˺�õ���ҺΪ����������������Ũ���ᡢ��ȴ�ᾧ�����˿ɵõ�FeSO4•7H2O��
��1���������������ӵļ��鷽�������ش����������������������Һ��Ѫ��ɫ��
��2���������̹�ϵͼ��������H2S������Һ�У�SnS������ȫʱ��Һ��pHΪ1.6��FeS��ʼ����ʱ��Һ��pHΪ3.0�����������ϡ���������ҺPH=2Ϊ�˳�ȥ��������Sn2+��ͨ�������Ʊ��ͣ�������ǿ��ԭ����Ŀ���dz��������ӣ���ԭ�����ӣ���ֹ�������ӱ�������
��3������IV��Ŀ���Ǵ���Һ�������̷����壬��������Ũ�����ᾧϴ�ӵõ����壻
��4������IV�õ����̷�������������ˮϴ��Ŀ����ϴȥ�������ʣ��¶Ƚ����̷��ܽ�Ƚ��ͣ������̷��������ʧ��
��5�����ݵζ�ʵ��ķ�Ӧ�յ�ʱ�����ķ�Ӧ���м��㣬����ʵ������в��������������������жϣ�
��� �⣺��1�����������̷��������Ƿ���Fe3+��ʵ��������������������Ӽ��鷽������������������������������ӻᷴӦ������������Ѫ��ɫ��֤�������ӵĴ��ڣ�
�ʴ�Ϊ��ȡ������������ˮ���μ�KSCN��Һ����������Ѫ��ɫ������������Fe3+��
��2����֪����H2S������Һ�У�SnS������ȫʱ��Һ��pHΪ1.6��FeS��ʼ����ʱ��Һ��pHΪ3.0��������ȫʱ��pHΪ5.5������������Һ���������ữ��pH=2��Ŀ���ǣ�����ҺPH=2ʱ��Sn2+��ȫ�������������Ӳ�������ͨ�����������͵�Ŀ���ǣ��������ǿ��ԭ�ԣ���ȥFe3+����Ӧ�����ӷ���ʽΪ2Fe3++H2S=2Fe2++S+2H+��
�ʴ�Ϊ��ʹSn2+��ȫ���SnS��������Fe2+��������2Fe3++H2S=2Fe2++S+2H+��
��3����Һ�еõ����壬��Ҫ����Һ���м�������Ũ�����ᾧ����������ϴ�ӵȣ����Բ���IV��˳������Ϊ������Ũ�������½ᾧ�����ˡ�ϴ�ӣ�
�ʴ�Ϊ������Ũ��������������
��4����ˮ�¶ȵͣ������ܽ�ȼ�С������ϴȥ����������������ӣ������̷��ܽ��������ʧ��
�ʴ�Ϊ������ϴ�ӹ�����FeSO4•7H2O����ģ�
��5��a����ȡ2.8500g�̷���Ʒ���ܽ⣬��250mL����ƿ�ж��ݣ�
b����ȡ25.00mL������Һ����ƿ�У�
c���������ữ��0.01000mol/L KMnO4��Һ�ζ����յ㣬����KMnO4��Һ�����ƽ��ֵΪ20.00mL�����ݷ�Ӧ����ʽ��С���㣺
5Fe2++MnO4-+8H+�T5Fe3++Mn2++4H2O
5 1
n��Fe2+�� 0.01000mol/L��0.0200L
����õ���n��Fe2+��=0.001mol��
��250mL��Һ�к�Fe2+=0.001mol��$\frac{250}{25}$=0.01mol��
FeSO4•7H2O���ʵ���Ϊ0.01mol������=0.01mol��278g/mol=2.78g��
��������=$\frac{2.78g}{2.85g}$��100%=97.54%��
�ʴ�Ϊ��97.54%��
���� ���⿼�������������ε�����Ӧ�ã����������ʵ�鷽����ƺͷ����жϣ��ζ�ʵ��ķ����жϣ����ݼ��㣬�������ķ�������Ŀ�Ѷ��еȣ�


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ���� | ���� |
| ȡ4gƯ�۾����壬����100mLˮ | ���ֹ����ܽ⣬��Һ������ɫ |
| ���ˣ���Ư�۾���Һ��pH | pH��ֽ�ȱ�����ԼΪ12��������ɫ |
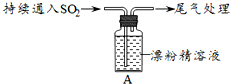 | i��Һ���Ϸ����ְ����� �����Ժ��ֻ��ǣ���Һ��Ϊ����ɫ�� �����Ժ���������ɫ����������ɫ��ȥ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
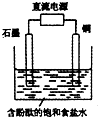
| A�� | ͭ�缫�Ϸ�����ԭ��Ӧ | B�� | ʯī�缫������Һ�ʺ�ɫ | ||
| C�� | ��Һ�е�Na+��ʯī�缫�ƶ� | D�� | ͭ�缫�����۲쵽����ɫ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1molHCl | B�� | 3.01��1023��O2 | C�� | 12g12C | D�� | 0.5molCH4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���³�ѹ�£�15g����-CH3��������������Ϊ6NA | |
| B�� | һ��������������Fe����Ũ���ᷴӦ��ת�Ƶ�����һ��Ϊ3NA | |
| C�� | ��1L��̼������Һ�У���c��CO32-��=1mol/L����Na+����Ϊ2NA | |
| D�� | ��4NA�����ӵĹ���Na2O2����ˮ���1L��Һ��������Һ��Na+��Ũ��Ϊ1mol/L |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Ͷ����Ƭ����H2����Һ�пɴ�������H+��Mg2+��SO42-��NO3- | |
| B�� | ���������������������䰱ˮ�У�SO2+NH3•H2O�THSO3-+NH4+ | |
| C�� | 1.0mol•L-1��KNO3��Һ�пɴ�������H+��Fe2+��Cl-��SO42- | |
| D�� | ��ͭ������������ӷ���ʽΪCuS+2H+�TH2S��+Cu2+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 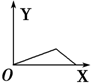 | B�� | 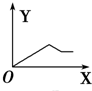 | C�� | 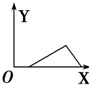 | D�� |  |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �������һ���ǹ��ۻ����� | |
| B�� | ��������ˮ����c��OH-��=c��NH4+��ʱ������NH3•H2O���봦��ƽ��״̬ | |
| C�� | ǿ�������Һ�в��������ʷ��ӣ����������Һ�д������ʷ��� | |
| D�� | ��0.1 mol•L-1һԪ��BOH��pH=10����֪��Һ�д���BOH�TB++OH- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
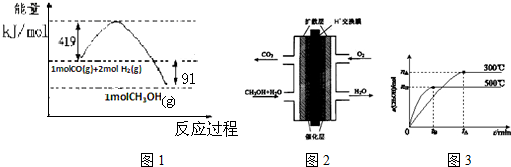
| ��ѧ�� | H-H | H-O | O=O |
| ����KJ/mol | 436 | x | 496 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com