
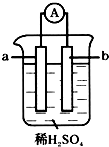
 已知在金属活动性顺序表中,a为排在氢前面的金属.在如图所示的装置中,b为碳棒,关于此装置的各种叙述中,不正确的是( )
已知在金属活动性顺序表中,a为排在氢前面的金属.在如图所示的装置中,b为碳棒,关于此装置的各种叙述中,不正确的是( )| A. | 碳棒上有气体放出,溶液酸性变弱 | B. | a是正极,b是负极 | ||
| C. | 导线中有电子从a极到b极 | D. | a极上发生了氧化反应 |
分析 a的活动性比氢要强,b为碳棒,该装置能自发的发生氧化还原反应而构成原电池,a作负极,碳棒作正极,负极上金属失电子发生氧化反应,碳棒上氢离子得电子发生还原反应,电子从负极沿导线流向正极.
解答 解:A.该原电池中金属作负极,碳棒b作正极,负极上金属失电子发生氧化反应,正极碳上氢离子得电子发生还原反应,所以溶液中氢离子浓度减小,溶液的PH增大,故A正确;
B.该原电池中,金属的金属性大于氢元素,所以金属a作负极,碳棒b作正极,故B错误;符合题意.
C.该装置能构成原电池,所以有电流产生,电子从负极a沿导线流向正极b,故C正确;
D.a作负极,负极上失电子发生氧化反应,故D正确;
故选:B.
点评 本题考查了原电池工作原理.原电池中正负极的判断不能仅凭金属的活泼性判断,要根据电极反应的反应类型、电子的流向等方面判断.


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:选择题
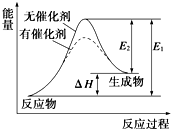 某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列有关叙述正确的是( )
某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列有关叙述正确的是( )| A. | 该反应为放热反应 | |
| B. | 该反应的反应热等于E1-E2 | |
| C. | 催化剂能改变该反应的焓变 | |
| D. | 逆反应的活化能大于正反应的活化能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.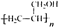 ,写出合成流程图(无机试剂任用).合成流程图示例如下:
,写出合成流程图(无机试剂任用).合成流程图示例如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该合金中铜与镁的物质的量之比是2:1 | |
| B. | 可得到2.54 g沉淀 | |
| C. | 如果是铜铝合金,则产生的NO2 的体积不会是1344mL | |
| D. | 恰好全部沉淀时,加入NaOH溶液的体积是600 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将纯水加热到950C时,Kw变大,pH不变,水仍呈中性 | |
| B. | 向纯水中加入稀氨水,平衡逆向移动,c(OH-)增大,Kw变小 | |
| C. | 向水中加入少量固体硫酸氢钠,c(H+)增大,平衡逆向移动,KW不变 | |
| D. | 向水中通入HCl气体,平衡逆向移动,溶液导电能力减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,NaA溶液的pH=8,则c(Na+)-c(A-)=9.9×10-7 | |
| B. | pH=5.6的CH3COOH与CH3COONa混合溶液中,c(Na+)>(CH3COO-) | |
| C. | 0.1mol•L-1的NaHSO3的溶液中C(Na+)>C(HSO3-)>C(H+)>C(SO32-)>C(OH-) | |
| D. | 浓度均为0.1mol/L的 CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)] |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “冰十六”的密度比液态水小 | B. | “冰十六”与干冰由不同分子构成 | ||
| C. | “冰十六”可以包合气体分子 | D. | 液态水转变成“冰十六”是化学变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com