
| mg |
| 67,5g/mol |
| m |
| 13,5 |
| mg |
| 71g/mol |
| 2m |
| 71 |
| m |
| 13.5 |
| 2m |
| 71 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
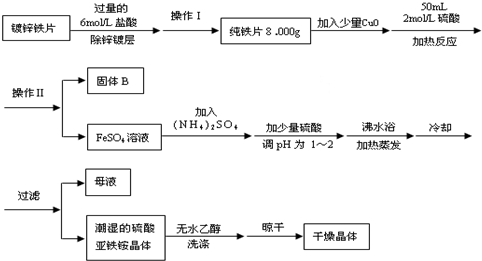
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2010年宁波市八校高二下学期期末联考化学试题 题型:选择题
已知重铬酸钾(K2Cr2O7)是一种中学化学常用的强氧化剂,重铬酸钾溶液中存在如下平衡:
H+(aq)+ CrO42-(aq) Cr2O72-(aq)+H2O 。若要使溶液的橙色加深,下列可采用的方法是:
Cr2O72-(aq)+H2O 。若要使溶液的橙色加深,下列可采用的方法是:
A.加入适量稀盐酸 B.加入适量稀硝酸 C.加入适量烧碱固体 D.加水稀释
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com