
| A£®c(H£«)£¾c(SO42-)£¾c(NH4+) |
| B£®c(NH4+)£«c(H£«)£½2c(SO42-)£«c(OH£) |
| C£®c(H£«)£½c(NH4+)£«c(NH3”¤H2O)£«c(OH£) |
| D£®ŹŅĪĀĻĀµĪ¼ÓNaOHČÜŅŗÖĮÖŠŠŌŗó£ŗc(Na£«)£¾c(SO42-)£¾c(NH4+)£¾c(OH£)£½c(H£«) |
 æĪĢĆČ«½ā×Ö“Ź¾ä¶ĪĘŖÕĀĻµĮŠ“š°ø
æĪĢĆČ«½ā×Ö“Ź¾ä¶ĪĘŖÕĀĻµĮŠ“š°ø ²½²½øßæŚĖćĢāæØĻµĮŠ“š°ø
²½²½øßæŚĖćĢāæØĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®ŌŚŗ£ĀÖĶāæĒÉĻĻāČėŠææ飬æɼõ»ŗ“¬ĢåµÄøÆŹ“ĖŁĀŹ |
| B£®¼ÓČČ”¢Õō·¢MgCl2±„ŗĶČÜŅŗæɵĆĪŽĖ®MgCl2¾§Ģå |
| C£®¹¤ŅµÉĻÓĆŹÆ»ŅČé¶ŌĆŗČ¼ÉÕŗóŠĪ³ÉµÄŃĢĘų½ųŠŠĶŃĮņ£¬×īÖÕÄÜÖʵƏÆøą |
| D£®ŹŅĪĀĻĀ£¬c(NH4+)ĻąµČµÄ(NH4)2SO4”¢NH4HCO3”¢NH4ClČÜŅŗÖŠ£ŗc(NH4)2SO4£¼c(NH4Cl)£¼c(NH4HCO3) |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®c(Cl-)>c(N)>c(H+)>c(OH-) | B£®c(N)>c(Cl-)>c(H+)>c(OH-) |
| C£®c(Cl-)=c(N)>c(H+)=c(OH-) | D£®c(N)=c(Cl-)>c(H+)>c(OH-) |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®ŠĀÖĘĀČĖ®ÖŠ¼ÓČė¹ĢĢåNaOH£ŗc(Na£«)£½c(Cl£)£«c(ClO£)£«c(OH£) |
| B£®pH£½8£®3µÄNaHCO3ČÜŅŗ£ŗc(Na£«)>c(HCO3-)>c(CO32-)>c(H2CO3) |
| C£®³£ĪĀĻĀ£¬pH£½7µÄNH4ClÓė°±Ė®µÄ»ģŗĻČÜŅŗÖŠ£ŗc(Cl£)£½c(NH4+)>c(OH£)£½c(H£«) |
| D£®0£®1 mol”¤L£1CH3COONaČÜŅŗÖŠ£ŗc(OH£)£½c(CH3COOH)£«c(H£«) |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®a£½b£½c | B£®a£¾b£¾c |
| C£®a£¾c£¾b | D£®c£¾a£¾b |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā

 H+ + HA££»HA”Ŗ
H+ + HA££»HA”Ŗ  H+ + A2£
H+ + A2£²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
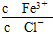 Ōö“ó£¬æɼÓČėµÄĪļÖŹŹĒ(””””)
Ōö“ó£¬æɼÓČėµÄĪļÖŹŹĒ(””””)| A£®ŹŹĮæµÄHClĘųĢå | B£®ŹŹĮæµÄĮņĖįĒāÄĘ |
| C£®ŹŹĮæµÄNaOH¹ĢĢå | D£®ŹŹĮæµÄNaHCO3ČÜŅŗ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®ĪļÖŹµÄĮæÅضČĻąµČCH3COOHŗĶCH3COONaČÜŅŗµČĢå»ż»ģŗĻ£ŗ c(CH3COO-) + c(CH3COOH)=2c(Na+) |
| B£®0.1 mol/L Na2CO3ČÜŅŗ£ŗc(OH£)£½c(HCO3£)£«c(H£«)£«c(H2CO3) |
| C£®ĪļÖŹµÄĮæÅضČĻąµČNa2CO3ŗĶNaHCO3ČÜŅŗµČĢå»ż»ģŗĻ£¬Ąė×ÓÅØ¶ČµÄ“óŠ”Ė³ŠņŹĒ c (Na+)>c (HCO3-)> c(CO32£)>c(OH-)> c(H£«) |
| D£®NH4ClČÜŅŗÖŠ£ŗc(H+) = c(NH3”¤H2O) +c(OH-) |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| ĪļÖŹ | MgCl2 | Mg(OH)2 | MgCO3 |
| Čܽā¶Č(g/100 g) | 74 | 0.000 84 | 0.01 |
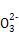 ),ĒŅc(Mg2+)”¤c(C
),ĒŅc(Mg2+)”¤c(C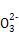 )=6.82”Į10-6
)=6.82”Į10-6 µÄÓ²Ė®,·¢ÉśµÄĄė×Ó·“Ó¦·½³ĢŹ½ĪŖMg2++2HC
µÄÓ²Ė®,·¢ÉśµÄĄė×Ó·“Ó¦·½³ĢŹ½ĪŖMg2++2HC +Ca2++2OH-
+Ca2++2OH- CaCO3”ż+MgCO3”ż+2H2O
CaCO3”ż+MgCO3”ż+2H2O²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com