

组号 | 反应温度 (℃) | 参加反应的物质 | ||||
| Na2S2O3 | H2SO4 | H2O | ||||
| V/ml | c/mol•L-1 | V/ml | c/mol•L-1 | V/ml | ||
| A | 10 | 5 | 0.1 | 10 | 0.1 | 5 |
| B | 10 | 5 | 0.1 | 5 | 0.1 | a |
| C | 30 | 5 | 0.1 | 10 | 0.1 | 5 |
分析 (1)①淀粉遇碘变蓝,当碘消耗完时,蓝色褪去;
②A.根据移液的操作分析;
B.滴定管的0刻度在上端;
C.根据碱式滴定管排除气泡方法分析;
D.图D是有玻璃活塞的酸式滴定管;
③根据关系式2Cu2+~I2~2S2O32-可知铜离子与硫代硫酸的物质的量相等,根据公式c=$\frac{n}{V}$计算;
④根据标准液的体积偏大,测得的结果偏高进行分析;
(2)①根据反应方程式Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O可知用产生淡黄色沉淀的快慢来判断反应速率;
②A组和B组比较硫酸的浓度对反应速率的影响,其他条件要完全一样,所以控制溶液的总体积不变即可;
③A组与C组的温度不同,其他条件完全相同,比较的是温度对反应速率的影响.
解答 解:(1)①用Na2S2O3标准溶液滴定含碘单质的溶液,用淀粉作指示剂,淀粉遇碘变蓝,当碘消耗完时,蓝色褪去,所以滴定终点为最后一滴溶液滴下,溶液恰好由蓝色变为无色,且半分钟内不变化,
故答案为:淀粉;最后一滴溶液滴下,溶液恰好由蓝色变为无色,且半分钟内不变化;
②A.移液的操作是将移液管直立,接受器倾斜,管下端紧靠接受器内壁,放开食指,让溶液沿接受器内壁流下,故A错误;
B.B图仪器不是滴定管,滴定管的0刻度在上端,故B错误;
C.对于碱式滴定管,可将橡皮管向上弯曲并在稍高于玻璃珠处用两手指挤压玻璃珠,使溶液从尖嘴处喷出,即可排除气泡,故C正确;
D.本实验是用硫代硫酸钠作标准液,该溶液呈碱性,应用碱式滴定管滴定,图D是有玻璃活塞的酸式滴定管,故D错误;
故答案为:C;
③根据关系式2Cu2+~I2~2S2O32-可知铜离子与硫代硫酸的物质的量相等,消耗Na2S2O3标准溶液19.80mL,浓度为0.1000mol/L,则铜离子的浓度c=$\frac{n}{V}$=$\frac{0.1000mol/L×19.80mL}{20mL}$=0.099mol/L,故答案为;0.099;
④A.锥形瓶用蒸馏水洗涤后,直接盛待测液,对实验无影响,故A不选;
B.滴定前滴定管尖嘴内有气泡,滴定后尖嘴无气泡,导致标准液的体积偏大,使结果偏高,故B选;
C.摇荡锥形瓶时溶液溅出,导致标准液的体积偏小,使结果偏低,故C不选;
D.锥形瓶中溶液颜色发生变化时立即读数,此时还未达终点,标准液体积偏小,使结果偏低,故D不选;
故答案为:B;
(2)①硫代硫酸钠和硫酸反应生成硫酸钠、硫、二氧化硫和水,反应方程式为:Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O,则可以通过出现淡黄色沉淀的快慢来判断反应速率的快慢,故答案为:出现淡黄色沉淀的快慢;
②A组和B组比较硫酸的浓度对反应速率的影响,其他条件要完全一样,所以控制溶液的总体积不变就保证了硫代硫酸钠溶液的浓度不变,A组溶液的总体积是20mL,则B组中加入的水的体积为(20-5-5)mL=10mL,故答案为:10mL;
③A组与C组的温度不同,其他条件完全相同,比较的是温度对反应速率的影响,C组的温度高,反应速率快,先出现淡黄色沉淀,
故答案为:其他条件相同时,温度越高,反应速率越快.
点评 本题考查了物质含量的测定以及化学反应速率的影响因素,涉及滴定操作方法及计算、计量仪器的构造及使用等知识,综合性强,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验次数 | B与混合气体的体积比 | 反应后气体密度(已换算为标准状况;g/L) |
| 第一次 | 1.0 | 1.35 |
| 第二次 | 1.2 | 1.25 |
| 第三次 | 2.0 | 1.04 |
| 第四次 | 2.2 | -- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
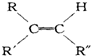 $→_{②Zn/H_{2}O}^{①O_{3}}$
$→_{②Zn/H_{2}O}^{①O_{3}}$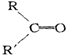 +
+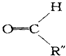 .
. ,C
,C ,E
,E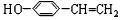 .
.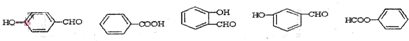 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (1)(3)(6)(8)(9)(11) | B. | (2)(3)(6)(10)(11)(13) | C. | (3)(8)(9)(10)(11)(12) | D. | (4)(5)(7)(10)(11)(14) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用FeCl3溶液腐蚀铜线路板:Cu+2Fe3+═Cu2++2Fe2+ | |
| B. | Na2O2与H2O反应制备O2:Na2O2+H2O═2Na++2OH-+O2↑ | |
| C. | 将氯气溶于水制备次氯酸:Cl2+H2O═2H++Cl-+ClO- | |
| D. | 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在该反应中碘酸钠作还原剂 | |
| B. | 碱性条件下,氯气的氧化性强于高碘酸钠的氧化性 | |
| C. | 反应中氧化产物与还原产物的物质的量之比为2:1 | |
| D. | 反应中生成1 mol Na2H3IO6转移2 mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去甲烷中少量的乙烯:气体通过溴水溶液的洗气瓶 | |
| B. | 除去乙酸乙酯中少量的乙酸:用氢氧化钠溶液洗涤,分液、干燥、蒸馏 | |
| C. | 除去CO2中少量的SO2:气体通过盛饱和碳酸氢钠氢溶液的洗气瓶 | |
| D. | 除去乙醇中少量的乙酸:加足量生石灰,蒸馏 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com