
下列溶液中溶质的物质的量浓度为1mol/L的是
A.将40gNaOH固体溶解于1L水中
B.将22.4L氨气溶于水配成1L溶液
C.将1L10mol/L的浓盐酸与9L水混合
D.将250g胆矾溶于水得到1L溶液
 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源:2016-2017学年江苏省高一上期中化学试卷(解析版) 题型:选择题
对电解质的叙述正确的是
A.溶于水后得到的溶液能导电的物质
B.NaCl溶液在电流作用下电离成Na+和Cl-
C.NaCl是电解质,故NaCl晶体能导电
D.氯化氢溶于水能导电,但液态氯化氢不能导电
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南郸城高级中学高二上第二次考试化学卷(解析版) 题型:填空题
反应①Fe(s)+CO2(g)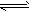 FeO(s)+CO(g) △H1=a kJ/mol;
FeO(s)+CO(g) △H1=a kJ/mol;
②CO(g)+1/2O2(g)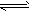 CO2(g) △H2=b kJ/mol
CO2(g) △H2=b kJ/mol
测得在不同温度下,反应①的平衡常数K值随温度的变化如下:

(1)若500℃时进行反应①,CO2起始浓度为2 mol·L-1,CO的平衡浓度为 。
(2)反应①中的a 0(填“大于”“小于”或“等于”)。
(3)70 0℃反应①达到平衡,要使该平衡正向移动,其他条件不变时,可以采取的措施有 (填序号)。
0℃反应①达到平衡,要使该平衡正向移动,其他条件不变时,可以采取的措施有 (填序号)。
A.缩小反应器体积 B.通入CO2
C.升高温度到900℃ D.使用合适的催化剂
(4)下列图像符合反应①的是__________(填序号)(图中v是速率、 为混合物中CO含量,T为温度且T1> T2)
为混合物中CO含量,T为温度且T1> T2)
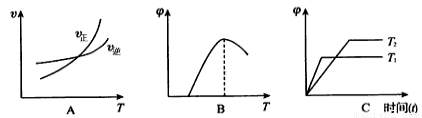
(5)由反应①和②可求得:2Fe(s)+O2(g) 2FeO(s) △H3,该反应的△H3= kJ/mol。(用含a、b的代数式表示)
2FeO(s) △H3,该反应的△H3= kJ/mol。(用含a、b的代数式表示)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南郸城高级中学高二上第二次考试化学卷(解析版) 题型:选择题
在常温下下列可逆反应的平衡移动均伴随着颜色变化,但颜色变化一定不受压强变化影响的是( )
A.2NO2 N2O4 B.2NO2
N2O4 B.2NO2 2NO+O2
2NO+O2
C.2HI H2+I2
H2+I2  D.FeCl3+3KSCN
D.FeCl3+3KSCN Fe(SCN)3+3KCl
Fe(SCN)3+3KCl
查看答案和解析>>
科目:高中化学 来源:2016-2017学年贵州贵阳花溪清华中学高一上月考一化学卷(解析版) 题型:填空题
氯化钾样品中含有少量碳酸钾、硫酸钾和不溶于水的杂质。为了提纯氯化钾,先将样品溶于适量水中,充分搅拌后过滤,再将滤液按下图所示步骤进行操作。
回答下列问题:
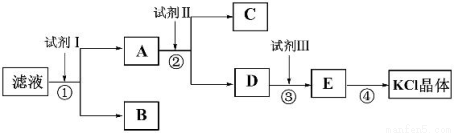
(1)①中发生反应的化学方程式为__________。
(2)②中加入试剂Ⅱ的目的是__________。
(3)操作④为蒸发,蒸发的作用之一是得到KCl晶体,另一作用是__________。
(4)某同学称取提纯的产品0.76g,溶解后定容在100mL容量瓶中,取25.00mL溶液,与25.00mL浓度为0.1000mol/L的硝酸银溶液恰好完全反应,则该产品的纯度为__________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年贵州贵阳花溪清华中学高一上月考一化学卷(解析版) 题型:选择题
下列说法正确的是
A.6.02×1023就是阿伏加德罗常数
B.1mol氧含6.02×1023个O2
C.1mol任何气体所含的气体分子数目都相等
D.摩尔是国际单位制中的一个基本物理量
查看答案和解析>>
科目:高中化学 来源:2017届黑龙江大庆实验中学高三上期中化学卷(解析版) 题型:推断题
框图中甲、乙为单质,其余均为化合物,B为常见液态化合物,A为淡黄色固体,F、G所含元素相同且均为氯化物,G遇KSCN溶液显红色。
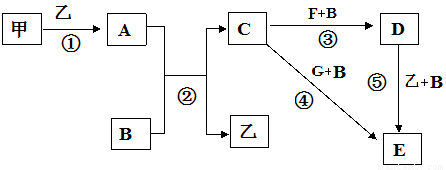
请问答下列问题:
(1)反应①-⑤中,既属于氧化还原反应又属于化合反应的是______________(填序号)。
(2)反应⑤的化学方程式为____________________________。
(3)甲与B反应的离子方程式 _______________________________。
(4)在实验室将C溶液滴入F溶液中,观察到的现象是______________________。
(5)在F溶液中加入等物质的量的A,发生反应的总的离子方程式为:__________________ 。
。
(6)已知:酚酞在c(OH-) 为1.0×10-4mol/L~2.5mol/L时呈红色,且半分钟内不褪色。向3.9g A和50g B混合后的溶液中滴入2滴酚酞试液,溶液变红色,片刻红色褪去(假设过程中液体体 积不变)。
积不变)。
①甲同学认为“红色迅速褪去”是由于溶液中c(OH-)过大造成的,上述观点是否正确 。
②乙同学认为“红色迅速褪去”是由于A + B = 碱 + H2O2 ,H2O2具有氧化性和漂白性导致的,设计实验证明烧瓶内溶液中含H2O2,简述实验方法 。
查看答案和解析>>
科目:高中化学 来源:2017届河南省高三上期中化学试卷(解析版) 题型:填空题
丙烯腈(CH2=CHCN)是一种重要的化工原料,工业上可用“丙烯氨氧化法”生产,主要副产物有丙烯醛(CH2=CHCHO)和乙腈 CH3CN 等,回答下列问题:
(1)以丙烯、氨、氧气为原料,在催化剂存在下生成丙烯腈( C3H3N)和副产物丙烯醛( C3H4O)的热化学方程式如下:
①C3H6(g)+NH3(g)+1.5O2(g)=C3H3N(g)+3H2O(g) △H=-515kJ·mol-1
②C3H6(g)+O2(g)=C3H4O(g)+H2O(g) △H=-353kJ·mol-1
两个反应在热力学上趋势均很大,其原因是____________;有利于提高丙烯腈平衡产率的反应条件是_______________;提高丙烯腈反应选择性的关键因素是___________。
(2)图(a)为丙烯腈产率与反应温度的关系曲线,最高产率对应温度为460℃。低于460℃时,丙烯腈的产率___________(填“是”或者“不是”)对应温度下的平衡产率,判断理由是______________;高于460℃时,丙烯腈产率降低的可能原因是___________(双选,填标号)。
A.催化剂活性降低 B.平衡常数变大 C.副反应增多 D.反应活化能增大
(3)丙烯腈和丙烯醛的产率与 n(氨) /n(丙烯)的关系如图(b所示。
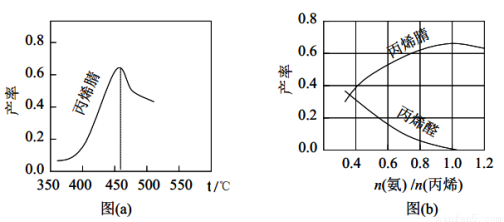
由图可知,最佳 n(氨) /n(丙烯)约为_____________,理由是______________________。进料氨、空气、丙烯的理论体积约为____________。
查看答案和解析>>
科目:高中化学 来源:2017届黑龙江哈尔滨三中高三上期中化学试卷(解析版) 题型:选择题
下列说法中,正确的是
A.原电池是利用氧化还原反应将化学能转换为电能的装置
B.由于生铁中含碳,所以比纯铁耐腐蚀
C.在原电池中,电子从正极流向负极
D.在原电池中,负极上发生还原反应,正极上发生氧化反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com