
在2 L密闭容器中,发生3A(g)+B(g) 2C(g)的反应,若最初加入A和B都是4 mol,A的平均反应速率为0.12 mol·L-1·s-1,则10 s后容器中B的物质的量浓度是( )
2C(g)的反应,若最初加入A和B都是4 mol,A的平均反应速率为0.12 mol·L-1·s-1,则10 s后容器中B的物质的量浓度是( )
A.1.4 mol·L-1 B.1.6 mol·L-1
C.1.8 mol·L-1 D.3.2 mol·L-1
 星级口算天天练系列答案
星级口算天天练系列答案科目:高中化学 来源: 题型:
某条件下,在2 L密闭容器中发生如下反应2NO2(g) 2NO(g)+O2(g)
在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在850℃,NO、O2的起始浓度都为0,NO2的浓度(mol·L-1)随时间(min)的变化如图所示。请回答下列问题:
在2L密闭容器内,800℃时反应:2NO2(g)2NO(g)+O2(g)体系中,n (NO2)随时间的变化如表:
⑴实验Ⅱ隐含的反应条件是
⑵写出该反应的平衡常数表达式: K= 。
该反应是________(填“吸”或“ 放”)热反应。
⑶若实验Ⅰ中达平衡后,再向密闭容器中通入2 mol由物质的量之比为1:1组成的NO2与O2混合气体(保持温度不变),则平衡将 移动。
⑷若将上述第⑶题所得的平衡混和气体通入足量的NaOH溶液中,使气体被完全吸收。
生成的产物及其物质的量为 。
⑸NO2、NO是重要的大气污染物,近年来人们利用NH3在一定条件下与之反应而将其转
化为无害的参与大气循环的物质,该反应的化学方程式为 。
(任写一个)
查看答案和解析>>
科目:高中化学 来源:2012-2013学年上海市浦东新区高三下学期二模化学试卷(解析版) 题型:填空题
碳单质在工业上有多种用途。例如焦炭可用来制取水煤气、冶炼金属,活性炭可处理大气污染物NO。
一定条件下,在2 L密闭容器中加入NO和活性炭(无杂质)反应生成气体A和B。当温度在T1℃时,测得各物质平衡时物质的量如下表:
|
|
活性炭 (mol) |
NO (mol) |
A (mol) |
B (mol) |
|
初始 |
2.030 |
0.100 |
0 |
0 |
|
平衡 |
2.000 |
0.040 |
0.030 |
0.030 |
(1)在T1℃时,达到平衡共耗时2分钟,则NO的平均反应速率为 mol/(L·min);当活性炭消耗0.015mol时,反应的时间 (填“大于”、“小于”或“等于”)1分钟。
(2)在T1℃下反应达到平衡后,下列措施不能改变NO的转化率的是 。
a.增大活性炭的量 b.增大压强 c.升高温度 d.移去部分B
(3)结合上表数据,该反应的平衡常数表达式为 。(生成物A、B用相应的化学式表示)若T1℃时的平衡常数为K1,T2℃时的平衡常数为K2,且K1>K2,能否判断该反应是吸热反应还是放热反应,说明理 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年浙江省招生仿真卷理科综合化学试卷(解析版) 题型:填空题
(15分)纳米级Cu2 O 粉末,由于量子尺寸效应,其具有特殊的光学、电学及光电化学性质,在太阳电池、传感器、超导体、制氢和电致变色、环境中处理有机污染物等方面有着潜在的应用。
Ⅰ.纳米氧化亚铜的制备
(1)四种制取Cu2O的方法如下:
①火法还原。用炭粉在高温条件下还原CuO;
②最新实验研究用肼(N2H4)还原新制Cu(OH)2可制备纳米级Cu2O,同时放出N2。
已知:N2H4(l)+O2(g) N2(g)+2H2O(l)
△H=-a
kJ/mol
N2(g)+2H2O(l)
△H=-a
kJ/mol
Cu(OH)2(s) CuO(s)+H2O(l) △H=b kJ/mol
CuO(s)+H2O(l) △H=b kJ/mol
4CuO(s) 2Cu2O(s)+O2(g)
△H=c
kJ/mol
2Cu2O(s)+O2(g)
△H=c
kJ/mol
则该方法制备Cu2O的热化学方程式为 。
③工业中主要采用电解法:用铜和钛作电极,电解氯化钠和氢氧化钠的混合溶液,电解总方程式为:2Cu+H2O Cu2O+H2↑,则阳极反应式为:
。
Cu2O+H2↑,则阳极反应式为:
。
④还可采用Na2SO3还原CuSO4法:将Na2SO3 和CuSO4加入溶解槽中,制成一定浓度的溶液,通入蒸气加热,于100℃~104℃间反应即可制得。写出该反应的化学方程式: 。
Ⅱ.纳米氧化亚铜的应用
(2)用制得的Cu2O进行催化分解水的实验
①一定温度下,在2 L密闭容器中加入纳米级Cu2O并通入10. 0 mol水蒸气,发生反应:
2H2O(g)  2H2(g)+O2(g)
△H=+484 kJ·mol-1
2H2(g)+O2(g)
△H=+484 kJ·mol-1
T1温度下不同时段产生O2的量见下表:
|
时间/min |
20 |
40 |
60 |
80 |
|
n(O2)/mol |
1.0 |
1.6 |
2.0 |
2.0 |
前20 min的反应速率 v(H2O)= ;该该温度下,反应的平衡常数的表达式K= ;若T2温度下K=0.4,T1 T2(填>、<、=)
②右图表示在t1时刻达到平衡后,只改变一个条件又达到平衡的不同时段内,H2的浓度随时间变化的情况,则t1时平衡的移动方向为 ,t2时改变的条件可能为 ;若以K1、K2、K3分别表示t1时刻起改变条件的三个时间段内的平衡常数,t3时刻没有加入或减少体系中的任何物质,则K1、K2、K3的关系为 ;

③用以上四种方法制得的Cu2O在其它条件相同下分别对水催化分解,产生氢气的速率v随时间t变化如图所示。下列叙述正确的是 。

A.方法③、④制得的Cu2O催化效率相对较高
B.方法④制得的Cu2O作催化剂时,水的平衡转化率最高
C.催化效果与Cu2O颗粒的粗细、表面活性等有
D.Cu2O催化水分解时,需要适宜的温度
查看答案和解析>>
科目:高中化学 来源:2010-2011学年江西省六校高三联考(理综)化学部分 题型:填空题
工业上用CO生产燃料甲醇。一定条件下发生反应:
CO(g)+2H2(g) CH3OH(g)。
CH3OH(g)。
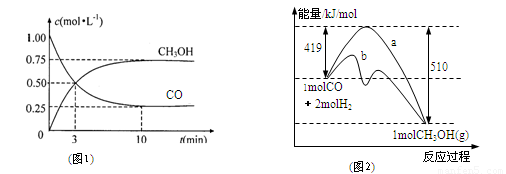
(1)该反应的平衡常数表达式为:K=
(2)图1是反应时CO和CH3OH(g)的浓度随时间的变化情况。从反应开始到平衡,用CO浓度变化表示的平均反应速率v(CO)= 。
(3)适宜的催化剂能 (选填序号)。
a.改变反应的热效应 b.降低生产能耗 c.加快反应速率
d.提高反应物的转化率
(4)在2 L密闭容器中发生反应CO(g)+2H2(g)  CH3OH(g)
若T℃时,加入2mol CH3OH,反应达平衡后,生成CO 1 mol,此时向容器中同时加入2 mol的CH3OH和4mol的H2混合气体(保持温度不变),则平衡将
(填“向正反应方向”、“向逆反应方向”或“不”)移动,达到新平衡后平衡常数K的值为
CH3OH(g)
若T℃时,加入2mol CH3OH,反应达平衡后,生成CO 1 mol,此时向容器中同时加入2 mol的CH3OH和4mol的H2混合气体(保持温度不变),则平衡将
(填“向正反应方向”、“向逆反应方向”或“不”)移动,达到新平衡后平衡常数K的值为
(5)恒容条件下,下列措施中能使n (CH3OH)/n (CO)增大的有 (选填序号)。
a. 升高温度 b. 使用催化剂 c.再充入2mol H2 d.再充入1mol CO
(6)甲醇可与氧气构成燃料电池,该电池用多孔的惰性电极浸入浓氢氧化钾溶液,写出该电池的负极反应式___________________
查看答案和解析>>
科目:高中化学 来源:2010年福建省福州市八县(市)协作校第一学期期中联考高二理科化学试卷 题型:选择题
反应A(g)+3B(g)  2C(g)在2 L密闭容器中反应,半分钟内C的物质的量增加了0.6mol,有关反应速率中正确的是( )
2C(g)在2 L密闭容器中反应,半分钟内C的物质的量增加了0.6mol,有关反应速率中正确的是( )
A.v(A)=0.005 mol·L-1·s-1
B.v(C)=0.02 mol·L-1·s-1
C.v(B)= v(A)/3
D..v(B)=0.01 mol·L-1·s-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com