
镍及其化合物用途广泛。某矿渣的主要成分是NiFe2O4(铁酸镍)、NiO、FeO、CaO、SiO2等,以下是从该矿渣中回收NiSO4的工艺路线:
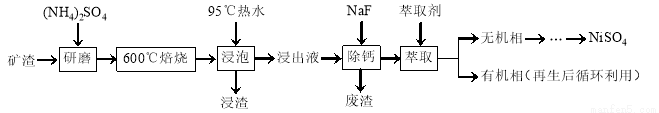
已知:(NH4)2SO4在350℃以上会分解生成NH3和H2SO4。NiFe2O4在焙烧过程中生成NiSO4、Fe2(SO4)3。锡(Sn)位于第五周期第ⅣA族。
(1)焙烧前将矿渣与(NH4)2SO4混合研磨,混合研磨的目的是______________。
(2)“浸泡”过程中Fe2(SO4)3生成FeO(OH)的离子方程式为______________,“浸渣”的成分除Fe2O3、FeO(OH)外还含有______________(填化学式)。
(3)为保证产品纯度,要检测“浸出液”的总铁量:取一定体积的浸出液,用盐酸酸化后,加入SnCl2将Fe3+还原为Fe2+,所需SnCl2的物质的量不少于Fe3+物质的量的________倍;除去过量的SnCl2后,再用酸性K2Cr2O7标准溶液滴定溶液中的Fe2+,还原产物为Cr3+,滴定时反应的离子方程式为______________。
(4)“浸出液”中c(Ca2+) = 1.0×10-3mol·L-1,当除钙率达到99%时,溶液中c(F-) = ________ mol·L-1。[已知Ksp (CaF2)=4.0×10-11]
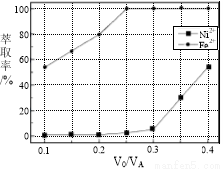
(5)本工艺中,萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如图所示,V0/VA的最佳取值是________。
科目:高中化学 来源:2016-2017学年湖北省宜昌市高二上期中化学卷(解析版) 题型:选择题
下列关于强、弱电解质的叙述,正确的是( )
A.稀硫酸是强电解质
B.弱电解质在水溶液中一定不能完全电离
C.强电解质的水溶液中不存在分子
D.弱电解质溶液的导电能力一定很弱
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上调研三化学卷(解析版) 题型:选择题
下表是在相同温度下三种酸的一些数据,下列判断正确的是( )
酸 | HX | HY | HZ | ||
浓度(mol/L) | 0.1 | 0.5 | 1 | 1 | 1 |
pH值 | 3.53 | 3.12 | 3.05 | 2.52 | 1 |
电离常数 | Ki1 | Ki2 | Ki3 | Ki4 | Ki5 |
A.Ki1>Ki2>Ki3 B.Ki5>Ki4>Ki3
C.NaZ溶液中c(H+) = c(OH-) D.HX + Y- === HY + X-
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上调研三化学卷(解析版) 题型:选择题
下列说法中正确的是( )
A.二氧化硫溶于水能导电,故二氧化硫属于电解质
B.硫酸钡难溶于水,故硫酸钡属于弱电解质
C.硫酸是强电解质,故纯硫酸能导电
D.氢氧根离子浓度相同的氢氧化钠溶液和氨水导电能力相同
查看答案和解析>>
科目:高中化学 来源:2017届湖北省高三12月月考化学试卷(解析版) 题型:选择题
关于下列各图像的说法中正确的是

A.图①表示将SO2气体通入溴水中
B.图②表示反应N2(g)+3H2(g) 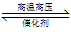 2NH3(g) ΔH<0的平衡常数K随温度的变化
2NH3(g) ΔH<0的平衡常数K随温度的变化
C.图③中阴、阳两极收集到的气体体积之比一定为1∶1
D.图④中的ΔH1<ΔH2
查看答案和解析>>
科目:高中化学 来源:2017届广东省广州市高三12月模拟化学试卷(解析版) 题型:选择题
用下列装置完成相关实验,合理的是( )
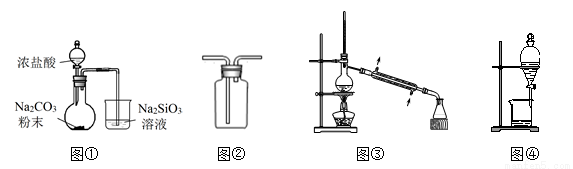
A.图①:验证H2CO3酸性强于H2SiO3
B.图②:收集CO2或NH3
C.图③:分离Na2CO3溶液与CH3COOC2H5
D.图④:分离CH3CH2OH与CH3COOC2H5
查看答案和解析>>
科目:高中化学 来源:2017届北京市高三12月月考化学试卷(解析版) 题型:填空题
海水是一个巨大的化学资源宝库,利用海水可以获得很多化工产品。
(1)海水中制得的氯化钠可用于生产烧碱及氯气。反应的离子方程式是 。

(2)利用制盐后的盐卤提取溴的工艺流程如下(部分操作和条件已略去):
将Br2与Na2CO3反应的化学方程式补充完整:
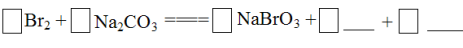
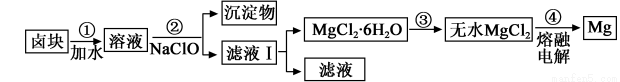
(3)盐卤蒸发冷却后析出卤块的主要成分是MgCl2,此外还含Fe2+、Fe3+、Mn2+等离子。以卤块为原料制得镁的工艺流程如下(部分操作和条件已略去):
生成氢氧化物沉淀的pH
物质 | 开始沉淀 | 沉淀完全 |
Fe(OH)3 | 2.7 | 3.7 |
Fe(OH)2 | 7.6 | 9.6 |
Mn(OH)2 | 8.3 | 9.8 |
Mg(OH) 2 | 9.6 | 11.1 |
①步骤②中需控制pH=9.8,其目的是 。
② 用NaClO 氧化Fe2+得到Fe(OH)3沉淀的离子反应方程式是 。
③ 步骤③需在HCl保护气中加热进行,请用化学平衡移动原理解释原因____________。
④ NaClO还能除去盐卤中的CO(NH2)2,生成盐和能参与大气循环的物质。除去0.1mol CO(NH2)2时消耗NaClO g。
查看答案和解析>>
科目:高中化学 来源:2017届福建省高三上学期阶段考二化学试卷(解析版) 题型:实验题
在接触法制硫酸的生产中,SO2转化成SO3转化率的大小直接决定生产效率。某研究小组用下图装置模拟生产过程中测定SO2转化成SO3的转化率。已知SO3的熔点是16.8℃,沸点是44.8℃。装置Ⅰ中所涉及反应的化学方程式为: 。
(1)Ⅱ中的试剂是 ,仪器Ⅵ的名称为 。装置Ⅲ发生反应的化学方程式是 。
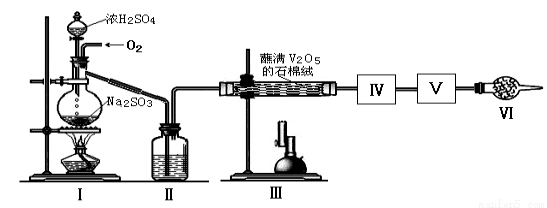
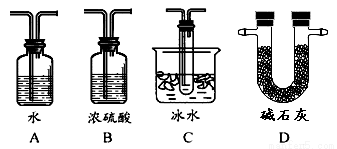
(2)根据实验需要,应该在Ⅳ、Ⅴ处连接合适的装置。请从下图A~D装置中选择最适合装置并将序号填入下面的空格中,Ⅳ、Ⅴ处连接的装置分别是 、 。
(3)为了提高SO2的转化率,实验时在:①滴加浓硫酸;②加热催化剂的步骤中,应采取的操作是先后顺序_____________(填编号)。
(4)实验结束后,如果把收集SO3的试管敞口露置于空气中,能够看到管口有大量的白雾,产生此现象的原因是 。
(5)用18.9gNa2SO3粉末与足量较浓的硫酸进行此实验,当反应结束时,继续通入O2一段时间后测得装置Ⅴ增重了7.2g,则实验测得SO2的转化率为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com