
(4分)水的电离平衡曲线如图所示: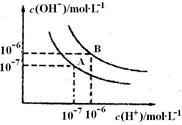
(1)A点表示25℃时水电离平衡时离子的浓度,当温度升高到100℃时,水的电离平衡状态变到B点,则100℃时水的离子积为_____________。
(2) 100℃时,若10体积的某强酸溶液与l体积的某强碱溶液混合后溶液呈中性,则混合之前,该强酸的pHa与强碱的pHb之间应满足的关系是______________。
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:单选题
常温下,有关醋酸溶液的叙述中错误的是
| A.pH=5.6的CH3COOH与CH3COONa混合溶液中:c(Na+)<c(CH3COOˉ) |
| B.将pH=3的醋酸稀释为pH=4的过程中,c(CH3COOH)/ c(H+)比值不变 |
| C.浓度均为0.1mol/L的CH3COOH与CH3COONa溶液等体积混合后:c(CH3COOˉ)+ c(CH3COOH)="2" c(Na+) |
| D.amLpH=3的醋酸溶液与bmLpH=11的NaOH溶液恰好完全中和时,a=b |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
把Ca(OH)2固体放入一定量的蒸馏水中,一定温度下达到平衡:Ca(OH)2(s) Ca2+(aq)+2OH-(aq)。向悬浊液中加少量生石灰,若温度保持不变 ,下列判断正确的是 ( )
Ca2+(aq)+2OH-(aq)。向悬浊液中加少量生石灰,若温度保持不变 ,下列判断正确的是 ( )
| A.溶液中Ca2+ 数目增多 | B.溶液中c(Ca2+)增大 |
| C.溶液pH值不变 | D.溶液pH值增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
含SO2的烟气会形成酸雨,工业上常利用Na2SO3溶液作为吸收液脱除烟气中的SO2。随着SO2的吸收,吸收液的pH不断变化。下列粒子浓度关系一定正确的是:
A.Na2SO3溶液中存在: |
B.已知NaHSO3溶液 ,该溶液中: ,该溶液中: |
C.当吸收液呈中性时: |
D.当吸收液呈酸性时: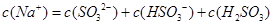 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(8分)硫酸镁在医疗上具有镇静、抗挛等功效。以菱镁矿(主要成分是MgCO3)为主要原料制备硫酸镁的方法如下: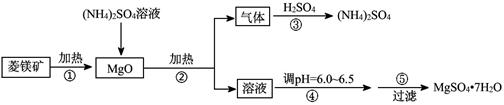
(1)步骤②中发生反应的离子方程式为 。
(2)步骤④中调节pH=6.0~6.5的目的是 。
(3)步骤⑤的操作为
(4)已知酸碱指示剂百里酚蓝变色的pH范围如表所示:
| pH | < 8.0 | 8.0 ~ 9.6 | > 9.6 |
| 颜色 | 黄色 | 绿色 | 蓝色 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在一定温度下,有a.盐酸 b.硫酸 c.醋酸三种酸:
(1)当三种酸物质的量浓度相同时,c(H+)由大到小的顺序是 。
(2)同体积、同物质的量浓度的三种酸,中和NaOH的能力由大到小的顺序是 。
(3)若三者c(H+)相同时,物质的量浓度由大到小的顺序是 。
(4)当三者c(H+)相同且体积也相同时,分别放入足量的锌,相同状况下产生气体的体积由大到小的顺序是 。
(5)当三者c(H+)相同且体积相同时,同时加入形状、密度、质量完全相同的锌,若产生相同体积的H2(相同状况),则开始时反应速率的大小关系为 ,反应所需时间的长短关系是 。
(6)将c(H+)相同的三种酸均加水稀释至原来的100倍后,c(H+)由大到小的顺序是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(12分)Ⅰ.(1)AgNO3的水溶液呈 (填“酸”、“中”、“碱”)性,常温时的pH 7(填“>”、“=”、“<”),原因是(用离子方程式表示): ;实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以 ________(填“促进”、“抑制”)其水解。
(2)在配制硫化钠溶液时,为了防止发生水解,可以加入少量的 。
Ⅱ. 已知水在25 ℃(A)和T ℃(B)时,其电离平衡曲线如图所示:
(1)25 ℃时,将pH=3 的H2SO4溶液与pH=10的NaOH溶液混合,若所得混合溶液的pH=7,则H2SO4溶液与NaOH溶液的体积比为 。
(2)T ℃时,若10体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强Ⅰ碱的pH2之间应满足的关系是 。
(3)曲线B对应温度下,pH=3的HCl溶液和pH=9的某碱溶液等体积混合后,混合溶液的pH>7。请分析其原因: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)pH=13的CH3COONa溶液加水稀释100倍后,pH________11(填“>”“=”或“<”)原因是______________________________________________(用离子方程式和必要的文字说明);pH相等的NaOH溶液与CH3COONa溶液,分别加热到相同的温度后CH3COONa溶液的pH________NaOH溶液的pH(填“>”“=”或“<”);
(2)pH相等时,①NH4Cl ②(NH4)2SO4 ③NH4HSO4三种溶液中c(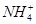 )由大到小的顺序为________;
)由大到小的顺序为________;
(3)等体积、等浓度的氢氧化钠与醋酸混合后溶液呈________性,溶液中c(Na+)________c(CH3COO-)(填“>”“=”或“<”);pH=13的氢氧化钠与pH=1的醋酸等体积混合后溶液呈________性,溶液中c(Na+)________c(CH3COO-)(填“>”“=”或“<”);
(4)将物质的量浓度相同的盐酸与氨水混合后,溶液中的c(NH)=c(Cl-),则混合后溶液呈________性,盐酸的体积________氨水的体积(填“>”“=”或“<”);
(5)NaHSO4在水中的电离方程式为NaHSO4=Na++H++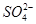 。该溶液中c(H+)_________________________c(OH-)+c(
。该溶液中c(H+)_________________________c(OH-)+c(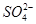 )(填“>”“=”或“<”)。
)(填“>”“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
常温下,如果取0.1 mol·L-1 HA溶液与0.1 mol·L-1 NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,试回答以下问题:
(1)混合溶液的pH=8的原因(用离子方程式表示): 。
(2)混合溶液中由水电离出的c(OH-) (填“>”、“<”或“=”)0.1 mol·L-1 NaOH溶液中由水电离出的c(OH-)。
(3)求出混合溶液中下列算式的精确计算结果(填具体数字):c(Na+)-c(A-)= mol·L-1,c(OH-)-c(HA)= mol·L-1。
(4)已知NH4A溶液为中性,又知HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH 7(填“>”、“<”或“=”);将同温度下等浓度的四种盐溶液:
A.NH4HCO3 B.NH4A C.(NH4)2SO4 D.NH4Cl
按pH由大到小的顺序排列是 (填序号)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com