
| A、c(Na+)+c(H+)=c(HSO3-)+c(SO32-)+c( OH-) |
| B、c(Na+)=c(H2SO3)+c(HSO3-)+c( H+) |
| C、c(SO32-)+c( OH-)=c(H+)+c(H2SO3) |
| D、c(Na+)>c(HSO3-)>c( OH-)>c(H2SO3)>c(SO32-)>c(H+) |
| 2.24L |
| 22.4L/mol |
| 2.24L |
| 22.4L/mol |


 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:
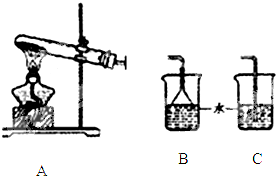 某研究性学习小组为了制取并探究氨气的性质,进行以下实验.[装置A中发生反应的化学方程式:2NH4Cl+Ca(OH)2
某研究性学习小组为了制取并探究氨气的性质,进行以下实验.[装置A中发生反应的化学方程式:2NH4Cl+Ca(OH)2
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、两者的原料来源相同 |
| B、两者的生产原理相同 |
| C、两者对食盐利用率不同 |
| D、两者最终产品都是Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 四种短周期元素A、B、C、D在元素周期表中的相对位置如图所示,其中D形成的两种氧化物都是大气污染物.下列有关判断正确的是( )
四种短周期元素A、B、C、D在元素周期表中的相对位置如图所示,其中D形成的两种氧化物都是大气污染物.下列有关判断正确的是( )| A、简单氢化物的热稳定性:C>A |
| B、最高价氧化物对应水化物的酸性:D<C |
| C、B的最高价氧化物的水化物能与D的最高价氧化物的水化物反应 |
| D、A、C、D的最高价含氧酸的钠盐水溶液可能均显碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、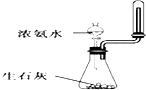 制取少量氨气 |
B、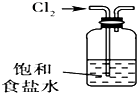 除去氯气中的HCl杂质 |
C、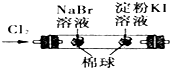 证明氧化性Cl2>Br2>I2 |
D、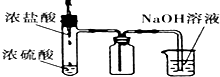 制取HCl且除去多余的气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、不含NO3-,也不含Fe3+ |
| B、含有NO3-、I-、Cl? |
| C、含I-,且肯定含有Cl- |
| D、可能含有Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
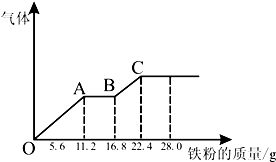 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份,向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体),向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图,下列分析或结果错误的是( )
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份,向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体),向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图,下列分析或结果错误的是( )| A、H2SO4浓度为4mol?L-1 |
| B、OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气 |
| C、每份混合酸中NO3-物质的量为0.3mol |
| D、第二份溶液中最终溶质为FeSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、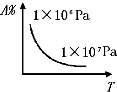 |
B、 |
C、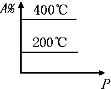 |
D、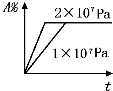 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com