

分析 废电路板中加入双氧水、氨气、氯化铵溶液,得到铜氨溶液和残渣,分离难溶性固体和溶液采用过滤方法,所以操作①是过滤,反应Ⅰ是将Cu转化为Cu(NH3)42+,Cu元素化合价由0价变为+2价,所以Cu是还原剂,则双氧水是氧化剂,将Cu氧化;反应Ⅱ是铜氨溶液中的Cu(NH3)42+与有机物RH反应,生成CuR2,同时生成NH4+和NH3;
互不相溶的液体采用分液方法分离,所以操作②是分液;向有机层中加入稀硫酸,根据流程图知,生成CuSO4和HR,然后采用分液方法分离得到HR,以石墨为电极电解硫酸铜溶液时,阳极上氢氧根离子放电、阴极上铜离子放电;从硫酸铜溶液中获取胆矾,采用加热浓缩、冷却结晶、过滤的方法得到晶体;
(1)双氧水具有氧化性,能氧化还原性物质,分离难溶性固体和溶液采用过滤方法;
(2)反应Ⅱ是铜氨溶液中的Cu(NH3)42+与有机物RH反应生成CuR2,同时生成NH4+和NH3,根据反应物和生成物书写该反应的离子方程式为;分离互不相溶的液体采用分液方法,分液时常用分液漏斗;
(3)反应Ⅲ是有机溶液中的CuR2与稀硫酸反应生成CuSO4和RH,分液时分液漏斗下端要紧靠烧杯内壁,且分液漏斗内不能盛放太多溶液;
(4)以石墨为电极电解硫酸铜溶液时,阳极上氢氧根离子放电、阴极上铜离子放电,SO42-向阳极移动;从溶液中获取晶体采用加热浓缩、冷却结晶、过滤方法;
(5)电解硫酸铜溶液时能得到硫酸,硫酸能循环利用;氯化铵电离出的铵根离子抑制一水合氨电离而降低溶液碱性.
解答 解:废电路板中加入双氧水、氨气、氯化铵溶液,得到铜氨溶液和残渣,分离难溶性固体和溶液采用过滤方法,所以操作①是过滤,反应Ⅰ是将Cu转化为Cu(NH3)42+,Cu元素化合价由0价变为+2价,所以Cu是还原剂,则双氧水是氧化剂,将Cu氧化;反应Ⅱ是铜氨溶液中的Cu(NH3)42+与有机物RH反应,生成CuR2,同时生成NH4+和NH3;
互不相溶的液体采用分液方法分离,所以操作②是分液;向有机层中加入稀硫酸,根据流程图知,生成CuSO4和HR,然后采用分液方法分离得到HR,以石墨为电极电解硫酸铜溶液时,阳极上氢氧根离子放电、阴极上铜离子放电;从硫酸铜溶液中获取胆矾,采用加热浓缩、冷却结晶、过滤的方法得到晶体;
(1)双氧水具有氧化性,能氧化还原性物质Cu,所以双氧水作氧化剂;分离难溶性固体和溶液采用过滤方法,该混合溶液中贵重金属是难溶物、铜氨溶液是液体,所以操作①是过滤,
故答案为:作氧化剂;过滤;
(2)反应Ⅱ是铜氨溶液中的Cu(NH3)42+与有机物RH反应生成CuR2,同时生成NH4+和NH3,根据反应物和生成物书写该反应的离子方程式Cu(NH3)42++2RH=2NH4++2NH3+CuR2;分离互不相溶的液体采用分液方法,分液时常用分液漏斗,分液的目的是富集铜元素、使铜元素与水溶液中的物质分离,所以ab正确,
故答案为:Cu(NH3)42++2RH=2NH4++2NH3+CuR2;分液漏斗;ab;
(3)反应Ⅲ是有机溶液中的CuR2与稀硫酸反应相当于复分解反应,所以生成CuSO4和RH,分液时分液漏斗下端要紧靠烧杯内壁,且分液漏斗内不能盛放太多溶液,
故答案为:RH;分液漏斗尖端未紧靠烧杯内壁;液体过多;
(4)以石墨为电极电解硫酸铜溶液时,阳极上氢氧根离子放电、阴极上铜离子放电,所以阳极上生成O2,同时有大量的H+生成,且SO42-也向阳极移动在阳极积累,因此阳极产物还有H2SO4;从溶液中获取晶体采用加热浓缩、冷却结晶、过滤方法,
故答案为:O2、H2SO4;加热浓缩、冷却结晶、过滤;
(5)电解硫酸铜溶液时能得到硫酸,在反应III中用到硫酸,所以H2SO4能循环利用;氯化铵电离出的铵根离子抑制一水合氨电离而降低溶液碱性,从而抑制氢氧化铜生成,
故答案为:H2SO4;防止由于溶液中c(OH-)过高,生成Cu(OH)2沉淀.
点评 本题考查物质分离和提纯方法的综合应用,题目难度较大,涉及基本实验操作、氧化还原反应、电解原理等知识,试题侧重考查学生实验操作规范性、知识综合应用能力,易错点是(5)题第一个空,合理把握图1中流程简图为解答关键.


科目:高中化学 来源: 题型:多选题
 ,下列说法正确的是( )
,下列说法正确的是( )| A. | 1mol该有机物最多可与3mol H2发生加成反应 | |
| B. | 能使酸性KMnO4溶液褪色 | |
| C. | 1mol该有机物分别与足量的金属钠、碳酸氢钠溶液反应均产生1mol气体 | |
| D. | 与乙酸互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2-乙基丁烷 | B. |  ;3-乙基-1-丁烯 ;3-乙基-1-丁烯 | ||
| C. | 2,6-二甲基-3-乙基庚烷 | D. | CH2=CH-CH=CH2;1,3,5-三己烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图所示晶体中每个阳离子A或阴离子B,均可被另一种离子以四面体形式包围着,则该晶体对应的化学式为( )
如图所示晶体中每个阳离子A或阴离子B,均可被另一种离子以四面体形式包围着,则该晶体对应的化学式为( )| A. | AB | B. | A2B | C. | AB3 | D. | A2B3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
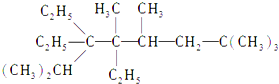 2,2,4,5,7,7-六甲基-3,3,4-乙基辛烷,
2,2,4,5,7,7-六甲基-3,3,4-乙基辛烷,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②③ | C. | ③① | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com